



细胞与基因治疗领域近年来取得了令人瞩目的突破,在恶性肿瘤、遗传病、罕见病等治疗中展现出巨大潜力,为众多患者带来了新希望。随着CAR-T疗法、基因编辑技术、溶瘤病毒等创新疗法相继获批上市,细胞与基因治疗的临床应用愈发广泛。
PART 01
细胞与基因治疗安全性风险及合规性要求
细胞与基因治疗产品通常借助病毒或非病毒载体,将外源基因导入靶细胞或组织,以实现基因替代、补偿、修正或敲除等治疗目的。但是,病毒或非病毒载体在宿主基因组中的随机整合,可能引发插入性突变,进而导致克隆扩增甚至肿瘤形成。BluebirdBio的体外干细胞基因治疗产品SKYSONA,用慢病毒载体导入外源基因,治疗肾上腺脑白质营养不良。开发过程中有 3例儿童被诊断出骨髓增生异常综合征(Myelodysplastic Syndrome,MDS),其中2例因慢病毒整合到原癌基因的克隆扩增所致 [1] 。2023年7月起,FDA调查已获批上市的6款CAR-T产品治疗后发生T淋巴细胞瘤的情况,确定这些CAR-T疗法存在继发性 T 细胞恶性肿瘤风险。对3例接受CAR-T治疗后发生癌变的患者基因测序,发现恶性细胞克隆中存在CAR基因。2024年4月18日,FDA正式要求更新黑框警告,提醒患者和处方医师相关风险,要求患者和临床试验参与者终身监测 [2-3] 。
因此,整合位点分析作为一项关键技术,在评估细胞与基因治疗产品的安全性方面发挥着举足轻重的作用。它不仅是合规要求,更是保障细胞与基因治疗长期安全性的关键工具。中国CDE和美国FDA等各国监管机构,已发布多项指导文件,明确要求开展整合位点分析,以评估插入性突变的风险。在药学和非临床安全性研究阶段,需要关注基因整合情况、插入位点和拷贝数,分析基因组改变特征,评估潜在风险。在临床研究阶段,需要长期随访监测克隆形成和继发肿瘤风险。整合位点分析不仅助力申办方满足法规要求,更为产品的上市和临床推广提供了有力支持。
PART 02
整合位点检测和分析方法解析
随着高通量测序与生物信息学分析技术的发展,整合位点检测与注释分析已可以为理解和判断风险提供重要的数据信息。现有的整合位点的检测多是基于分子生物学的方法,包括线性扩增介导的PCR(Linear Amplification-mediated PCR,LAM-PCR)、非限制性线性扩增介导的PCR(Non-restrictive Linear Amplification-mediated PCR, nrLAM-PCR)、连接介导的PCR(Ligation-mediated PCR,LM-PCR)、靶向富集测序(Target Enrichment Sequencing,TES)和全基因组测序(Whole Genome Sequencing, WGS)。其优缺点比较如下表:
表1 整合位点检测方法学比较

整合位点测序的数据有许多公共的分析方法或软件供使用,如INSPIIRED、PIC、IS-Seq和VISPA2等,可分析整合位点在基因组中的位置、分布、功能区,以及癌基因与非癌基因偏好性和多样性指数(如Chao1、香农指数、基尼系数和UC50等),综合评估整合位点安全性风险。
随着细胞与基因治疗从肿瘤向自身免疫疾病适应症的拓展,整合位点分析将在疗法安全性的纵向监测中发挥更为关键的作用,为保障患者安全、推动细胞与基因治疗领域的健康发展持续贡献力量。
PART 03
精翰生物整合位点检测介绍
精翰生物具备细胞与基因治疗中常见的慢病毒、逆转录病毒和非病毒载体(如转座子等)等整合位点检测和分析的能力。精翰生物的整合位点检测方法具有自主知识产权,自主设计锚定接头和引物,基于LM-PCR(Ligation-mediated PCR)的原理,针对载体LTR/ITR(Long terminal repeats/Inverted terminal repeats)区域进行2轮巢式PCR扩增,经过测序和生信分析,识别整合位点的位置、分布和所在功能区,并对偏好性和多样性进行统计学分析。此外,接头中还设计了分子标签(Unique molecular identifier,UMI),可以实现整合位点相对丰度的计算。有利于识别异常的单克隆或寡克隆。LM-PCR也是FDA获批药物评审报告中推荐的检测方法 [4] 。
精翰生物慢病毒整合位点检测已完成性能验证,全面支持全血、细胞注射液和DNA等样本的检测,具备丰富的经验,成功支持了多家申办方的IND申报、注册临床和长期随访,助力细胞与基因治疗药物的安全性检测。
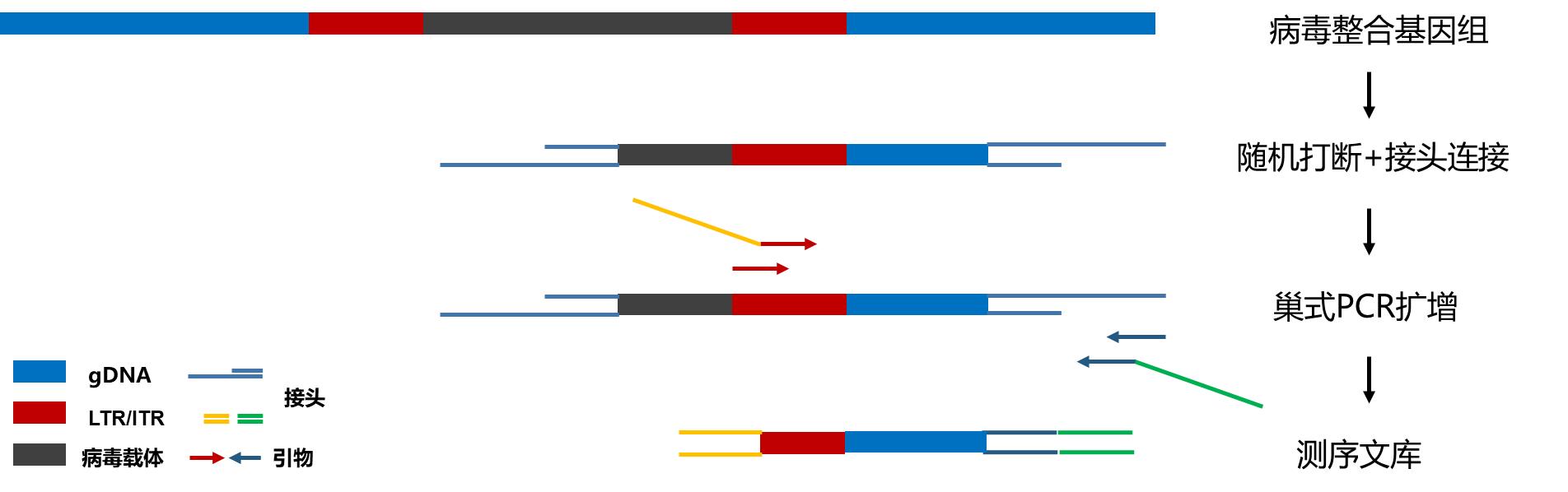
图1 LM-PCR建库原理示意图
参考文献:
[1] FDA. Cellular, Tissue, and Gene Therapies Advisory Committee Meeting [EB/OL]. 2022-06-09 [2024-10-24]. https://www.fda.gov/media/159010/download
[2] VERDUN N, MARKS P. Secondary Cancers after Chimeric Antigen Receptor T-Cell Therapy[J]. N Engl J Med. 2024, 390(7): 584-586.
[3] FDA. FDA Requires Boxed Warning for T cell Malignancies Following Treatment with BCMA-Directed or CD19-Directed Autologous Chimeric Antigen Receptor (CAR) T cell Immunotherapies [EB/OL]. 2024-04-18 [2024-10-24].
[4] FDA. Cellular, Tissue, and Gene Therapies Advisory Committee Meeting [EB/OL]. 2022-06-09 [2024-10-24]. https://www.fda.gov/media/159011/download
[5] 李振东,钟振鹏,董风晴,等.细胞与基因治疗产品评价中的基因组整合位点检测与分析[J].中国临床药理学杂志,2025,41(07):1013-1019.