



在药物研发进程中,药代动力学(PK)生物分析方法的变更或转移是常见情况。根据国际人用药品注册技术协调会(ICH M10)指南,当出现以下情况时必须进行交叉验证:"a) 在同一研究中采用不同充分验证的方法获得数据;b) 在同一研究中采用相同生物分析方法在不同实验室获得数据;c) 在不同研究中采用不同充分验证方法获得的数据将被合并或比较,用以支持特殊给药方案,或关于安全性、有效性和标签的监管决策"。
ICH M10推荐使用Bland-Altman图进行方法间的一致性评估。该方法通过将两种测量结果的差异与其均值进行可视化分析,为评估方法间一致性提供了直观依据。在此分析框架下,当缺乏公认参考方法时,两次测量结果的平均值被视为真实值的最佳估计。 基于此前提,该图的核心价值在于能够有效识别系统偏差,特别是判断差异是否随待测物浓度水平的变化而呈现某种趋势,即检测浓度依赖性偏差的存在。
然而,尽管ICH M10推荐使用Bland-Altman图进行评估,却并未明确给出用于判定两种方法是否等效的具体统计标准,这为实际工作中的决策带来了不确定性。针对上述问题,我们调研了现有文献与行业实践,并将在下文中总结基于Bland-Altman图的交叉验证一致性标准,以期为业界同仁提供参考。
PART 01
Bland-Altman图
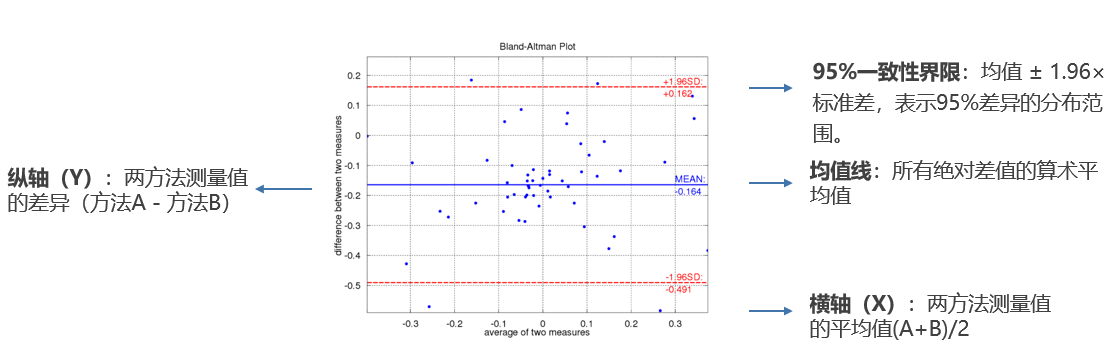
图1 Y轴为差值的B-A图
X轴:表示两种方法测量结果的平均值 (A+B)/2,作为待测物真实值的最佳估计。
Y轴:表示两种方法测量结果的差异 (A-B),或百分比差异 (A-B)/Mean × 100%。
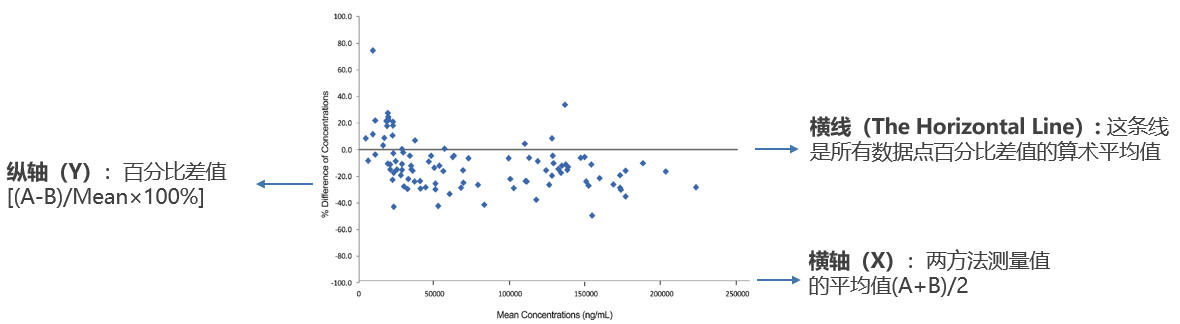
图2 Y轴为百分比差值的B-A图
在Bland-Altman分析中,纵坐标的设定直接影响对方法间一致性的解读。通常,纵坐标有两种表达方式:绝对差值(A-B)与百分比差值[(A-B)/Mean×100%]。这两种表达方式在图形解读上具有本质区别:
当采用绝对差值时,图形反映的是方法间差异的绝对量级。此时绘制的一致性界限为固定数值范围(如±2.5 μg/mL),适用于评估差异是否在全浓度范围内保持恒定。然而,在生物分析常见的宽浓度范围场景中,这种表达可能产生误导——低浓度时相同的绝对差异可能代表显著误差,而高浓度时则显得微不足道。
相比之下,百分比差值将差异表示为相对量,其一致性界限为相对范围(如±30%)。这种表达更符合生物分析方法验证中基于百分比的标准,能够消除浓度绝对值对差异解读的影响。当方法间存在比例性误差时,百分比差值的分布将呈现随机分布模式;若此时仍观察到明显趋势,则提示存在需要深入研究的非比例性系统误差。
在生物分析交叉验证实践中,由于待测物浓度常跨越数个数量级,且方法性能标准通常以相对误差定义,采用百分比差值作为纵坐标更能提供符合专业认知的一致性评估。
PART 02
Bland-Altman图一致性标准
基因泰克(Genentech)在其发表的交叉验证研究文章中,明确提出了一套与样本量相适应的标准框架。该框架包含一个主要标准及一项依样本量动态调整的次要标准,为交叉验证中的方法一致性评价提供了清晰且可操作的规范。
主要标准(适用于所有样本量):
两种方法的一致性判断必须满足:全部样本浓度百分比差值均值的90%置信区间完全落在±30%范围内。无论总样本量多少,此主要标准均为必须达成的先决条件。
次要根据(针对浓度依赖性偏倚):
若斜率的90%置信区间包含0:认为不存在浓度依赖性偏倚;
若斜率的90%置信区间不包含0:需进行亚组分析;
样本量≥约70:进行四分位分析(Q1、Q2&3、Q4)。若所有亚组的90%置信区间均在±30%内,则认为无浓度依赖性偏倚;
样本量约40-50:将样本分为两个浓度亚组(高低各半)。若两个亚组的90%置信区间均在±30%内,则认为无浓度依赖性偏倚;
样本量≤30:不建议进行亚组分析。应依赖主要标准并结合Bland-Altman图的直观观察进行评估。
PART 03
交叉验证一致性标准的设立依据
交叉验证中所采用的一致性标准,其设定主要参考了行业通行实践与统计学的通用原则。具体来看,±30%判定阈值的设置,主要借鉴了实际样本再分析(ISR)中常用的接受标准。该阈值为两个在不同实验室或平台中均经过完整验证的方法之间的比较,设定了可接受的偏差范围。
在置信区间的选择方面,90%置信水平的设定参考了生物等效性研究中的常见做法。该置信水平在行业中被广泛用于评价方法间的一致性,采用这一标准有助于使本次方法比较的评估过程与业界常用统计规范保持一致,从而增强结果的可比性。
PART 04
案例
在明确了交叉验证的科学标准后,让我们通过一个真实案例来看看这套标准如何落地。基因泰克在推进抗TIGIT抗体tiragolumab的全球临床研究时,就面临一个关键问题:同一检测方法在不同实验室能否产生一致可信的数据?他们用完整的验证过程给出了答案。
实验对象与样本
研究采用了100份来自全球临床试验的人血清实际研究样本为分析对象。样本选择采用分层抽样策略,覆盖6 μg/mL至252 μg/mL的预期浓度范围,并按浓度四分位数进行不等量抽样,其中最低浓度区间(Q1)和最高浓度区间(Q4)各抽取30份样本,中间浓度区间(Q2与Q3)共抽取40份样本,以确保在全浓度范围内均具有充分的代表性。
分析方法
研究采用酶联免疫吸附分析法对tiragolumab进行定量分析。该方法以TIGIT为靶点,使用生物素标记的TIGIT作为捕获试剂,地高辛标记的TIGIT作为检测试剂,通过夹心ELISA原理实现目标物的特异性检测。
统计方法
统计分析采用基于Bland-Altman分析的交叉验证策略。主要评价标准为全部样本百分比差值均值的90%置信区间需完全落在±30%范围内。辅助分析包括绘制百分比差值与浓度均值的Bland-Altman散点图,以及计算百分比差值与浓度均值回归斜率的90%置信区间。若斜率置信区间不包含0,则进一步进行浓度四分位亚组分析。
核心结果
统计分析显示,100个样本的百分比差值均值为-3.82%,其90%置信区间为[-5.89%, -1.76%],完全满足预设的±30%等效性标准。回归斜率的90%置信区间[-0.00005, 0.00003]包含0,表明不存在浓度依赖性偏倚。Bland-Altman图显示虽有2个样本的百分比差异超出±30%,但未呈现明显的浓度依赖趋势。综上,该ELISA方法在两个实验室间具有良好的一致性,可用于同一临床试验中不同实验室数据的合并与分析。
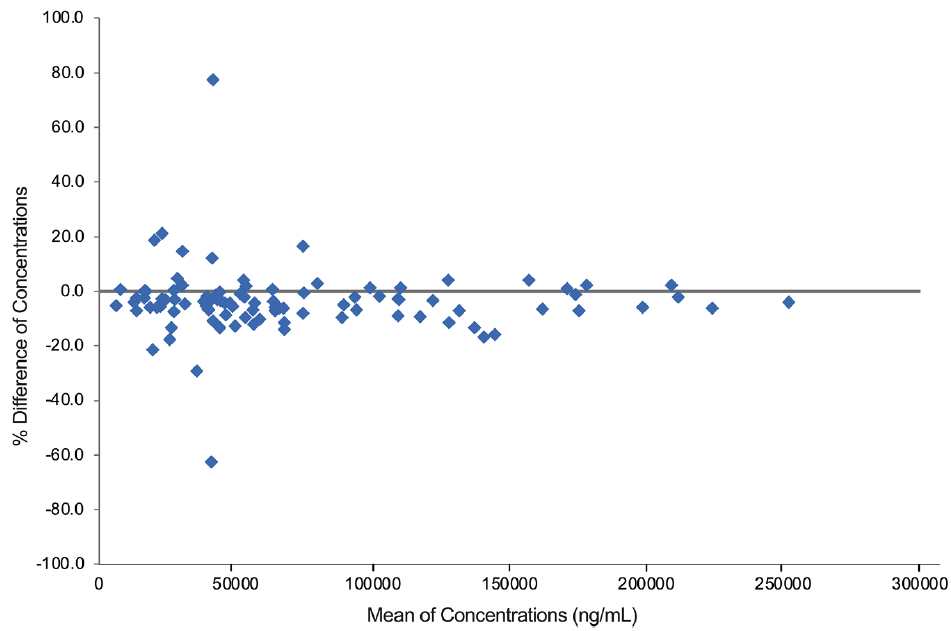
图3 两个不同实验室使用相同生物分析方法的Bland-Altman百分比差异图
注:百分比差值计算公式:((实验室B浓度 - 实验室A浓度)/(实验室A浓度与实验室B浓度的平均值))× 100%
表1 两个不同实验室使用相同生物分析方法的百分比差异及斜率统计分析

在现有监管框架下,常规生物分析交叉验证的样本量通常需达到监管指南建议的30例及以上,这使得基于总体样本的主要标准(90%置信区间落在±30%内)成为实践中应用最广泛的判断依据。然而,如本研究所呈现,当样本量充足时(如n=100),通过斜率分析与浓度四分位评估的次要标准能够有效识别潜在的浓度依赖性偏倚,为方法可比性提供更深层次的科学依据。对这部分内容感兴趣的读者,可进一步参阅原文中案例二的详细讨论。
PART 05
熙宁|精翰免疫分析平台
基于ICH M10推荐的交叉验证策略,熙宁生物|精翰生物免疫分析平台在生物分析方法比对与转移方面拥有丰富项目经验,并已建立起完善的技术服务体系。我们依托自身技术优势,配备专业统计能力,为客户提供符合监管要求的整合统计分析方法的交叉验证服务。该体系已在多个实际项目中成功应用,能够确保交叉验证研究既满足监管要求,又具备充分的科学严谨性。
参考文献:
[1] Nijem et al. Cross validation of pharmacokinetic bioanalytical methods: Experimental and statistical design. J Pharm Biomed Anal. 2025;252:116485.
[2] European Medicines Agency, ICH guideline M10 on bioanalytical method validation and study sample analysis, 2022.
[3] J.M. Bland, D.G. Altman. Statistical methods for assessing agreement between two methods of clinical measurement.