



心血管疾病是全球人口死亡的首要原因[1],我国更是全球心血管疾病负担最重的国家之一,其导致的死亡占我国人口总死亡的40%以上[2],其中动脉粥样硬化性心血管病(Atherosclerotic Cardiovascular Disease, ASCVD)占心血管疾病死亡的60%以上[3]。
动脉粥样硬化性疾病是指动脉粥样硬化病变引发的重要器官血液供应障碍、进而导致器官功能紊乱的疾病,主要包括冠状动脉粥样硬化性心脏病、动脉粥样硬化性脑血管病、肢体动脉粥样硬化、肾动脉粥样硬化、颈动脉粥样硬化和主动脉瘤等。ASCVD是一种与脂质代谢和炎症息息相关的慢性进展性血管疾病,其病变过程涉及多种血管细胞[4]与炎性免疫细胞[5],包括内皮细胞、平滑肌细胞、单核-巨噬细胞和中性粒细胞等。患者病情的轻重缓急与其病变部位高度相关。
动脉粥样硬化的发病过程十分复杂,其确切病因尚未完全阐明,一般认为系由多种遗传和环境因素相互作用所致。动脉粥样硬化的发生发展机制涉及多种学说,分别有脂质浸润学说、血栓形成学说、损伤应答学说、氧化应激学说、炎症学说、单克隆学说、同型半胱氨酸学说、精氨酸学说、受体缺失学说、免疫反应学说、干细胞学说、表观遗传学说及基因调控学说和剪切应力学说[6]。
PART 01
ASCVD的主要发病机制-脂质浸润学说
脂质浸润学说是目前得到广泛认可的学说之一,其认为血脂异常在动脉粥样硬化形成和进展中发挥着重要作用,具体过程如下 [7]:
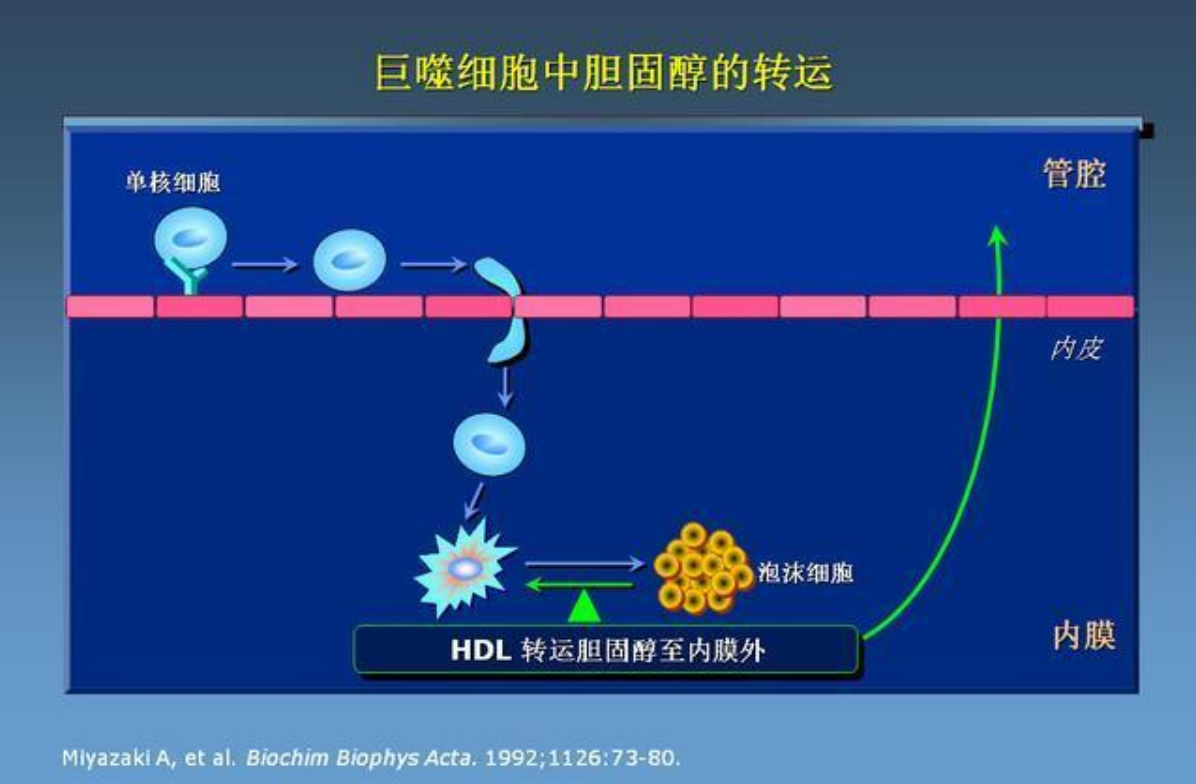
图1 脂质浸润学说

动脉内皮下脂质颗粒的蓄积与修饰
血液中脂质颗粒的浓度越高,动脉内皮下越容易蓄积以低密度脂蛋白(Low Density Lipoprotein, LDL)为主的脂质颗粒。过多沉积的脂质颗粒则需要依赖巨噬细胞的吞噬而清除。为了区别于血液中正常运行的脂质颗粒,便于巨噬细胞的识别,内皮下的脂质颗粒会与内膜下蛋白多糖结合并发生聚集,使其更易在酶促反应下被氧化或进行其它化学修饰。参与脂质颗粒氧化酶有内皮细胞产生的还原型辅酶II氧化酶、巨噬细胞与平滑肌细胞产生的脂质加氧酶和髓过氧化物酶等。

单核细胞的粘附与迁移
在修饰后的脂质颗粒等刺激因素的作用下,内皮细胞可产生单核细胞趋化蛋白-1,选择性地吸引单核细胞穿越内皮细胞间隙进入内皮下的脂质颗粒聚集部位。

泡沫细胞的形成
迁移至内皮下的单核细胞在修饰后的脂质颗粒的影响下分化为巨噬细胞。巨噬细胞通过其表面的清道夫受体识别并吞噬修饰的脂质颗粒,该吞噬过程不受所摄取胆固醇量的调节。巨噬细胞吞噬的脂质颗粒可通过高密度脂蛋白(High Density Lipoprotein, HDL)转运至内皮外,使巨噬细胞能够继续吞噬脂质颗粒,并最终完成清除工作。然而,如果脂质颗粒沉积过多,超过HDL的转运能力,巨噬细胞吞噬的脂质就会不断增多,形成泡沫细胞,最终死亡。大量死亡的泡沫细胞聚集形成脂池,并吸引动脉中层的平滑肌细胞迁移至内膜。随后,平滑肌细胞由收缩型衍变为合成型,并产生大量胶原和弹力纤维等,包裹脂池形成典型的粥样硬化病变。
PART 02
常见检测指标
基于脂质浸润学说,流行病学、遗传学和临床干预研究的证据充分证实:血脂、脂蛋白和载脂蛋白参与了ASCVD的病理生理过程,是ASCVD的致病性危险因素[8]。

血脂
血脂是血液中脂类物质的总称,包括总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TG)和类脂(如磷脂、糖脂等)等。临床上血脂检测的常规项目为TC、TG、高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)等,此外,小而密低密度脂蛋白 (small dense Low-Density Lipoprotein Cholesterol,sd LDL-C)和游离脂肪酸(Free fatty acid,FFA)的临床应用价值也在日益受到关注。

脂蛋白
脂蛋白是指血液中运送水不溶性脂类的超分子组装体(球状微粒),由富含胆固醇酯、甘油三酯的疏水性内核和由载脂蛋白、单层磷脂、胆固醇等组成的外壳构成。

图2 脂蛋白的结构
脂蛋白根据其水合密度、颗粒大小和载脂蛋白等的不同,分为乳糜微粒(Chylomicron,CM)、极低密度脂蛋白(Very Low‑Density Lipoprotein,VLDL)、中间密度脂蛋白(Intermediate‑Density Lipoprotein,IDL)、低密度脂蛋白(Low‑Density Lipoprotein,LDL)和高密度脂蛋白(High‑Density Lipoprotein,HDL)。如果进一步细分,VLDL可分为5个亚类(VLDL 1-5),LDL可分为6个亚类(LDL 1-6),HDL可分为4个亚类(HDL 1-4),各亚类的表达与功能不尽一致。此外,在LDL和HDL区带之间,还存在一种特殊的脂蛋白—脂蛋白(a)[lipoprotein(a),Lp(a)],它是ASCVD的一项独立的前瞻性危险性因素。脂蛋白的物理特性、主要成分、来源和功能如图3所示。目前临床上脂蛋白检测的项目为Lp(a)等,但由于脂蛋白在血液中一般呈球状,不易直接测定,因此临床上常通过检测血脂和载脂蛋白的含量来间接了解血液中脂蛋白的含量。

图3 脂蛋白的物理及生物学特性和功能
图表来源:中华医学会

载脂蛋白(Apo)
载脂蛋白(Apo)作为脂蛋白的重要组成部分,主要在肝脏(部分在小肠)合成,基本功能是运载脂类物质及稳定脂蛋白的结构,某些载脂蛋白还具有激活脂蛋白代谢酶、识别受体等功能。迄今已发现20余种Apo,按ABC系统命名,各类Apo又可细分为几个亚类,以罗马数字表示,如AⅠ、AⅡ、AⅣ、AⅤ、B48、B100、CⅠ、CⅡ、CⅢ、D、E、H、J和Apo(a)等。临床上载脂蛋白检测的项目为ApoA Ⅰ、ApoA Ⅱ、ApoB、ApoC Ⅱ、ApoC Ⅲ、ApoE等[9,10]。
在传统的血脂代谢紊乱治疗方案中,主要是让患者长期定时服用降血脂药物,包括他汀类药物、贝特类药物、胆固醇吸收抑制剂、前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂、高纯度鱼油制剂等,以改变血液中的血脂含量。在治疗过程中,通过监测上述多个指标的变化实时调整用药,来帮助患者进行严格的血脂控制,从而避免心脑血管事件的发生。
PART 03
靶向Lp(a)药物检测指标-intact Lp(a)
随着心血管领域研究的不断推进,对Lp(a)在心血管疾病中作用机制的理解也不断深入,Lp(a)已成为降脂药研发的新靶点。目前,全球范围内尚无靶向Lp(a)的药物获批上市,相关产品研发进展如下:
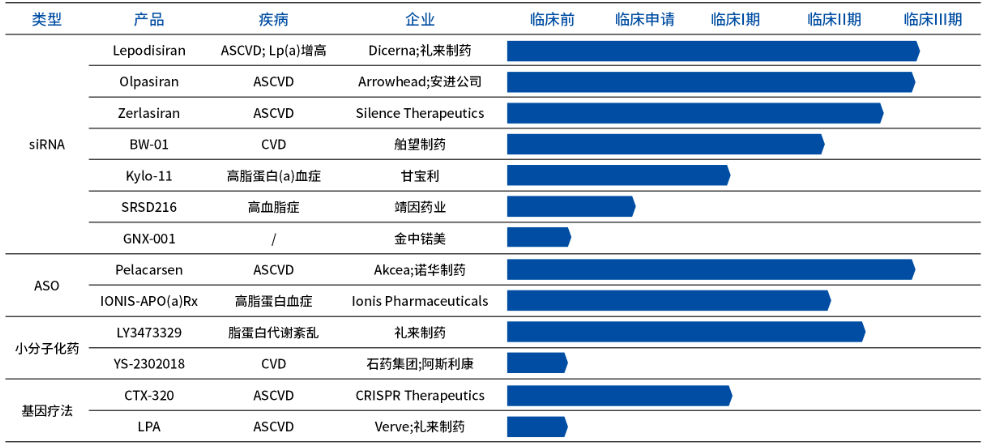
图4 不同类型靶向Lp(a)降脂药物研发进展
针对Lp(a)的结构和诱导心血管疾病的病理机制,药物研发方向主要有以下三个:
➢
限制Apo(a)的合成[11]:使用小干扰RNA(siRNA)药物来靶向抑制编码Apo(a)的LPA基因的表达,如Lepodisiran Sodium、Olpasiran、Zerlasiran;或者是使用靶向LPA基因的反义寡核苷酸(ASO)药物来抑制合成,如Pelacarsen、IONIS-APO(a)Rx。
➢
限制Lp(a)的组装[12]:使用小分子药物与Apo(a)的初始非共价键KIV7和KIV8结合,从而阻断Apo(a)和ApoB连接过程,进而抑制Lp(a)形成[13],如LY3473329。
➢
持续降低Lp(a)合成:使用CRISPR-gRNA-Cas9核酸酶脂质纳米粒制剂来靶向编辑Lp(a)基因,从而降低Lp(a)水平,如CTX-320。
Lp(a)由Apo(a)和包含载脂蛋白B-100(ApoB-100)的LDL类似颗粒按1:1的比例,通过二硫键连接而成,详见图5[14]。Apo(a)由肝细胞合成分泌,是一种高度多态性的亲水性糖蛋白,包含被称为Kringle的环状蛋白质结构,含有Kringle 4(KⅣ)型和Kringle 5(KV)型两种结构域。KⅣ有10种类型结构,KⅣ-2结构的重复次数由遗传决定且差异巨大,从而导致Apo(a)大小的多态性,其分子大小跨度在187kDa到662kDa范围内。除上述主体结构以外,Apo(a)还连接有一段无无蛋白水解活性的蛋白酶结构域,并且可以与OxPL结合,具有促炎活性。
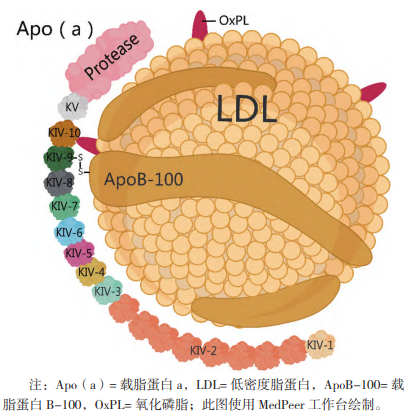
图5 脂蛋白a结构
由于Apo(a)的大小特异性,当采用针对KⅣ-2区域的抗体检测时,若患者的Apo(a)分子小于校准液中使用的Apo(a)分子,就会得到低于患者实际Lp(a)水平的结果,反之则高于。因此,传统的Lp(a)检测方法一般使用多克隆抗人Lp(a)兔抗来检测Lp(a),以避免KⅣ-2结构重复次数对检测结果的影响。同时该方法溯源至WHO/IFCC 国际参考试剂(SRM2B),从而实现Lp(a)测量的准确性和标准化。但由于该方法实际检测的是Apo(a)分子,因此无法区分游离的Apo(a)和Lp(a)分子。在常规情况下,血清中游离的Apo(a)分子仅占总Apo(a)分子的5%,因此对检测结果无显著影响;但使用了靶向Lp(a)药物的患者,尤其是使用了限制Lp(a)组装的小分子药物的患者,其血液中的Apo(a)分子的分布比例会产生显著变化。因此传统方法检测获得的结果可能高于实际结果,从而低估药物的疗效。故针对此类药物,应当检测intact Lp(a),即完整的Lp(a)。
PART 04
常用检测方法
不同的检测指标,所选用的检测方法各不相同,主要分为酶比色法、免疫比浊法和Elisa法。

酶比色法
主要是将靶标物质和底物共同孵育,经过酶促氧化,生成有特定颜色的产物,在一定波长下,形成特定的吸收峰,从而检测靶标物质的浓度。常用的检测项目主要为血脂类。其中,对于LDL-C、HDL-C和sd LDL-C这类需要进行区分检测的靶标物质,在孵育前会使用特定的表面活性剂来选择性地溶解除靶标物质以外的脂类,并提前氧化分解,避免对靶标物质的检测产生影响。随后再溶解靶标物质中的脂类,进行酶比色法检测。

免疫比浊法
主要通过抗原抗体的免疫反应,形成不溶的复合物,从而产生浊度,进而检测靶标物质的浓度。常用的检测项目主要为载脂蛋白类。其中,对于Lp(a)这类对灵敏度要求较高的靶标物质,会将抗体交联在乳胶微球上,从而促进抗原抗体的交联,使其在低浓度下即可产生浊度,显著提升检测灵敏度。

Elisa法
主要根据双抗夹心的检测原理,对靶标物质进行检测。常用的检测项目多为与药物相关的检测指标,如intact Lp(a)。使用抗Apo(a)抗体和抗ApoB 100抗体对Lp(a)进行检测,从而确保检测的是Lp(a)的完整结构,其结果不会受游离的Apo(a)和ApoB 100的影响。对于此类指标,可以同时辅以传统的检测方法,对二者数据进行比较,从而确证药物的疗效。但比较过程中,需要保证两个方法的溯源一致,否则可能由于抗体特异性等原因,导致最终结果差异显著,无法比较。
熙宁|精翰在生物血液样品中与ASCVD相关生物标志物的检测方法开发、验证和样品分析方面拥有丰富的经验,可提供抗血脂、载脂蛋白、脂蛋白等一系列的药效学分析服务,欢迎后台留言咨询。
参考文献:
[1] Roth G A, Mensah G A, Johnson C O, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 Study[J]. J Am Coll Cardiol,2020,76(25):2982-3021.
[2] The Writing Committee of the Annual Report on Cardiovascular Health and Diseases in China. Interpretation of annual report on cardiovascular health and diseases in China 2019.Cardiol Discov,2021,1(4):269-284.
[3] ZhaoD, LiuJ, WangM,et al. Epidemiology of cardiovascular disease in China: current features and implications[J]. Nat Rev Cardiol,2019,16(4):203-212.
[4] Libby P, Buring J E, Badimon L, et al. Atherosclerosis[J/OL]. Nat Rev Dis Primers, 2019, 5(1): 56[2023-10-18].
[5] 李婧玉,李琦,陈畅 . 免疫细胞在动脉粥样硬化进程中作用的研究进展 [J]. 药学进展 , 2023, 47(7): 542-550
[6] 李晨,李蓉,李立.动脉粥样硬化研究:缘起、观点及发展趋势[J]. 临床医学进展, 2022, 12(5): 4934-4950.
[7] Williams J K, Sukhova G K, Herrington D M, et al. Pravastatin Has Cholesterol-Lowering Independent Effects on the Artery Wall of Atherosclerotic Monkeys[J]. Journal of the American College of Cardiology, 1998, 31(3):684-691.
[8] Ference B A, Ginsberg H N, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel[J]. Eur Heart J, 2017, 38(32):2459-2472.
[9] 中国血脂管理指南修订联合专家委员会,李建军,赵水平,等.中国血脂管理指南(2023年)[J].中国循环杂志, 2023, 38(3):237-271.
[10] 中华医学会检验医学分会,中国医师协会检验医师分会,中国生物化学与分子生物学会脂质与脂蛋白专业委员会,等. 中国临床血脂检测指南[J]. 中华检验医学杂志,2022,45(10):1017-1033.
[11] O’DONOGHUE M L, ROSENSON R S, GENCER B, 等. Small Interfering RNA to Reduce Lipoprotein(a) in Cardiovascular Disease[J/OL]. The New England journal of medicine, 2022, 387(20): 1855-1864.
[12] Diaz N , Perez C , Escribano A M ,et al. Discovery of potent small-molecule inhibitors of lipoprotein(a) formation[J].Nature, 2024, 629(8013):24.
[13] Stephen J, Nicholls,Steven E, Nissen,Cynthia, Fleming et al. Muvalaplin, an Oral Small Molecule Inhibitor of Lipoprotein(a) Formation: A Randomized Clinical Trial.[J] .JAMA, 2023, 330: 0.
[14] 李婕,丁虎.脂蛋白a在心血管疾病中的研究新进展[J].中国全科医学, 2024, 27(36):4505-4514.