



鉴于TGN1412在首次人体试验中导致健康志愿者出现严重不良事件的教训,FDA和EMA相继发布了关于免疫激活产品FIH剂量选择的指导原则,特别强调包括双特异性抗体在内的免疫调节药物应采用"最小预期生物效应水平(MABEL)"作为剂量计算基础,即人体内可能产生生物学效应的最小剂量阈值。基于这一背景,本文以靶向GPC3/CD3的双特异性抗体为研究案例,系统性地阐述MABEL方法在FIH剂量确定中的具体应用,同时结合FDA 2017年的研究数据,深入分析CD3靶向与非CD3免疫激活双抗在剂量选择策略上的关键差异,以期为同行提供有价值的参考。
PART 01
ERY974
ERY974是一种与Glypican 3 (GPC3)和CD3结合的T 细胞重定向抗体 。该双特异性抗体具有独特的结构设计,其GPC3和CD3结合区共享一条共同轻链(common light chain),同时采用沉默型Fc段以消除由Fc介导的抗体依赖性细胞毒性(ADCC)效应所导致的不依赖于GPC3靶向性的细胞杀伤作用。
GPC3是一种硫酸乙酰肝素蛋白多糖和癌胎蛋白,其主要表达在胚胎发生过程中,成人组织中未观察到,但在各种癌症中却有高表达,尤其是肝细胞癌。

筛选ERY974最敏感的细胞系
案例中综合药理学和毒理学研究结果确定了首次人体(FIH)试验剂量方法如图1。采用MABEL(最小预期生物效应水平)方法时,首先在三种高表达GPC3的细胞系(HepG2、PC-10和huH-1)中筛选对ERY974最敏感的细胞系。通过检测细胞表面GPC3表达量,发现HepG2的抗体结合容量(ABC)最高(>1×10⁵),其次是PC-10和huH-1(图2)。随后使用四位供体的外周血单个核细胞(PBMCs),通过细胞毒性(LDH释放)和T细胞活化(CD69表达)实验比较了三株细胞的ERY974 EC10值。结果如图3所示,huH-1细胞的平均EC10值在两种实验中均为最低(细胞毒性实验0.0336ng/mL,T细胞活化实验0.0974ng/mL)(图2b),表明其对ERY974最具敏感性。
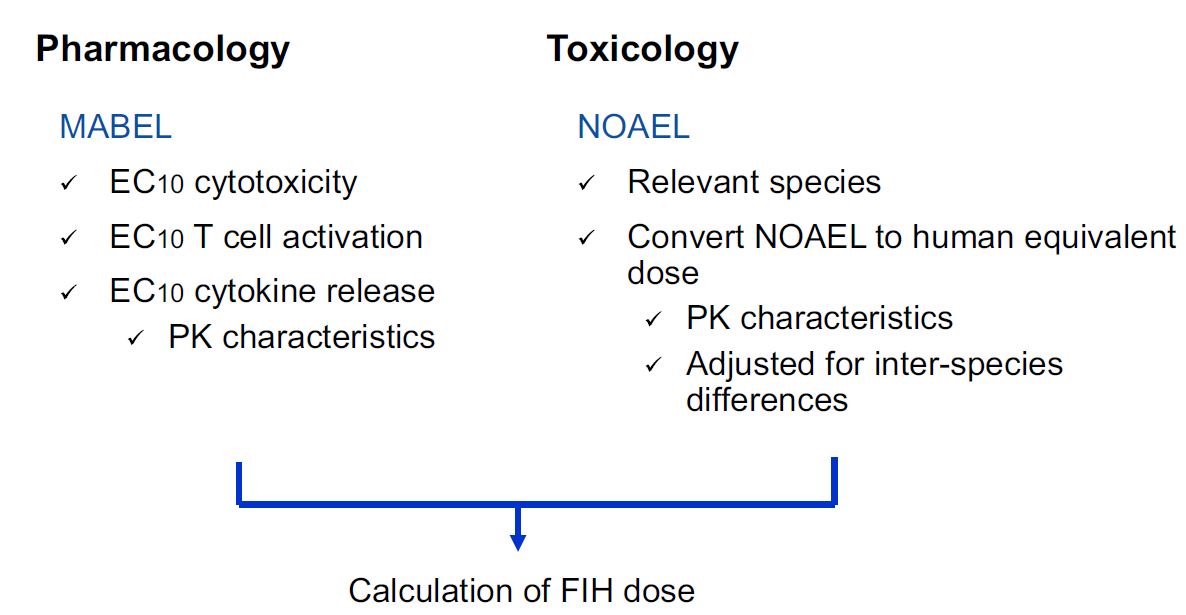
图1 ERY974 FIH剂量选择策略
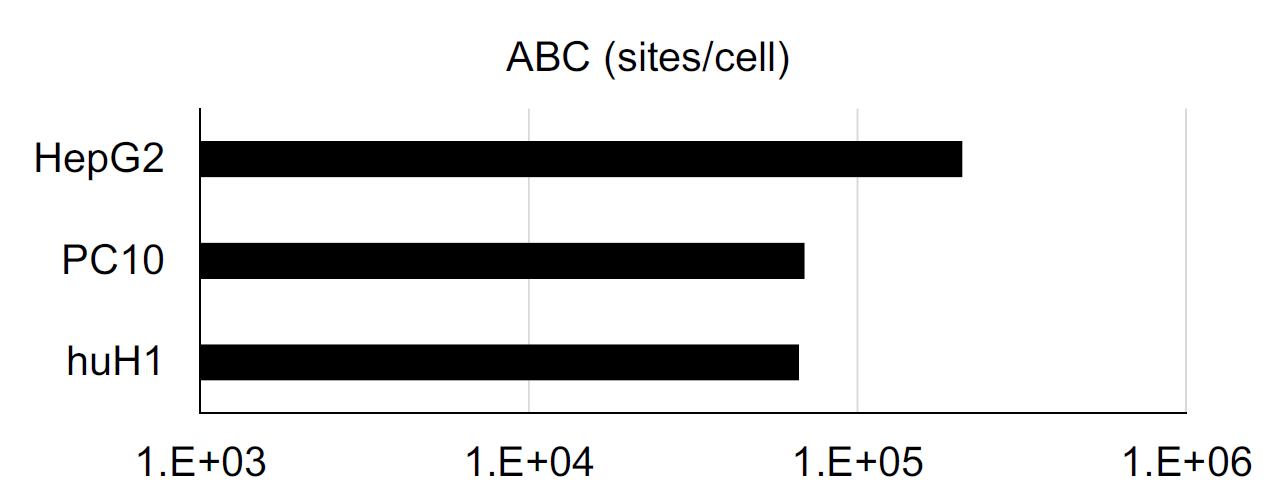
图2 HepG2、PC-10和huH-1细胞表面的GPC3表达水平
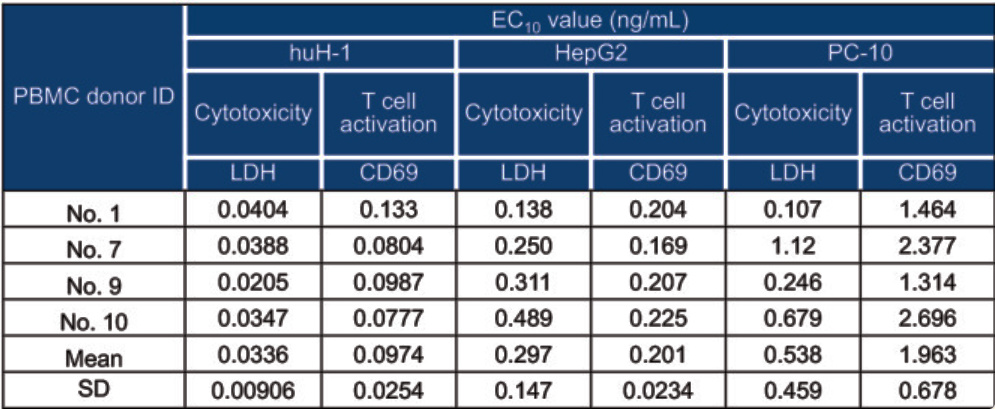
图3 ERY974在 HepG2 、 PC-10和huH-1中的细胞毒性和T细胞活化测定的EC10 值

使用 huH1 中的 EC10 值计算 ERY974 的 FIH 剂量
在ERY974处理24小时后,对细胞毒性实验、T细胞活化实验(通过CD69和CD25表达监测)以及细胞因子分泌实验[检测IL-2、IL-4、IL-6、IL-10、肿瘤坏死因子α(TNFα)和干扰素γ(IFNγ)]进行了敏感性比较(图4 a-c)。为考虑供体个体差异,随机选取了10份不同供体的PBMC样本。各实验的EC10均值结果如图所示:细胞毒性实验的EC10值最低(0.0767 ng/mL),显著优于T细胞活化和细胞因子检测,表明其敏感性最高。
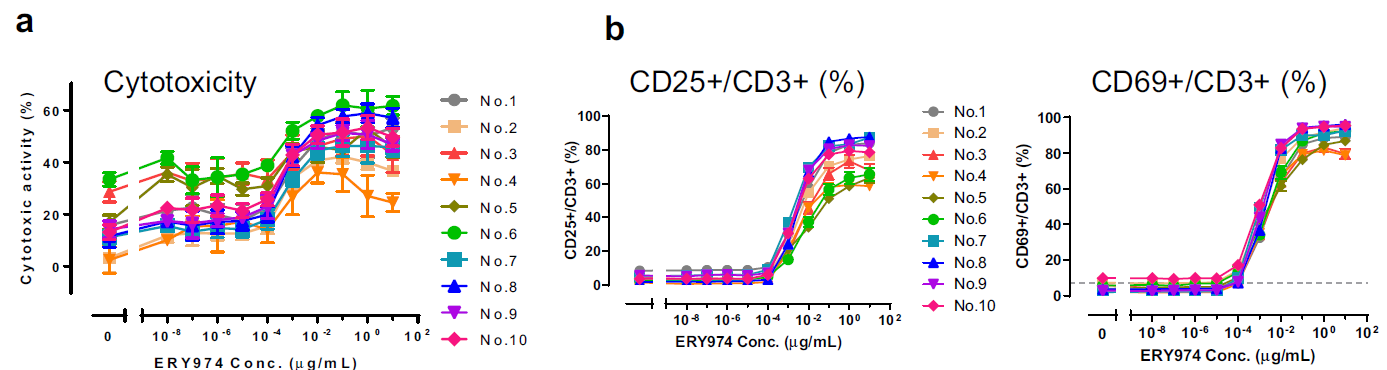
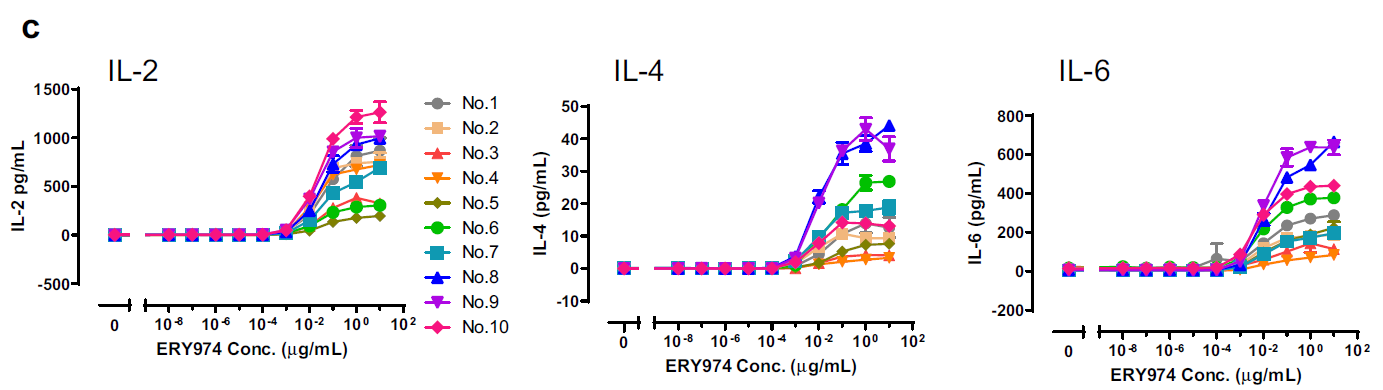
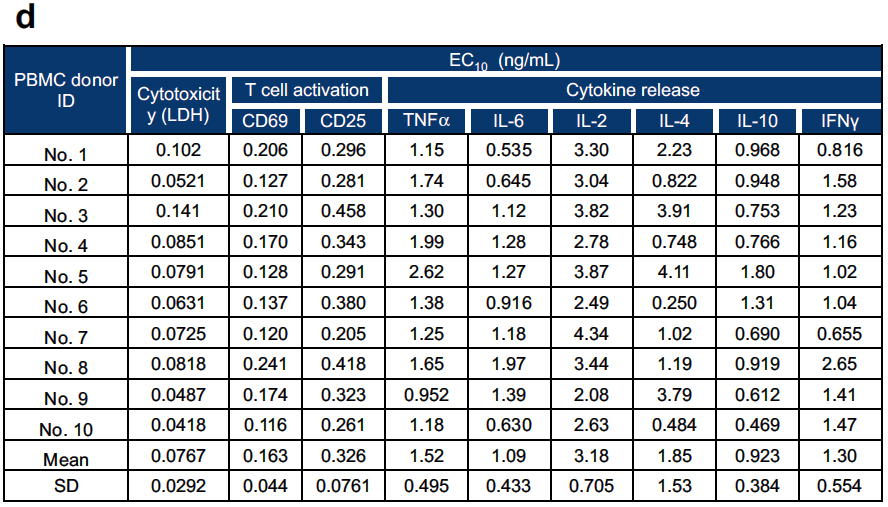
图 4 在huH-1细胞和外周血单个核细胞(PBMCs)中评估ERY974的药效学体外实验
(a) huH-1 中 ERY974 的细胞毒性测定。通过测量 huH-1 的 LDH 释放来计算细胞毒性。
(b) ERY974对T细胞活化标志物CD25和CD69表达的诱导作用。使用流式细胞术分析测量 ERY974 的 T 细胞活化标志物 CD25 和 CD69。
(c) ERY974诱导多种细胞因子(IL-2/IL-4/IL-6/IL-10/TNFα/IFNγ)产生的体外研究。
(d)细胞毒性试验是检测huH-1细胞中ERY974活性的最灵敏方法

ERY974对GPC3和CD3抗原的受体占有率(RO)的结果——未用于首次人体(FIH)剂量计算
尽管RO可预测抗体药物的药效学效应,但如下图所示,分别需要24ng/mL和3348ng/mL的ERY974才能覆盖细胞表面10%的GPC3和CD3。这些结果表明,达到10% RO需要较高剂量的ERY974。
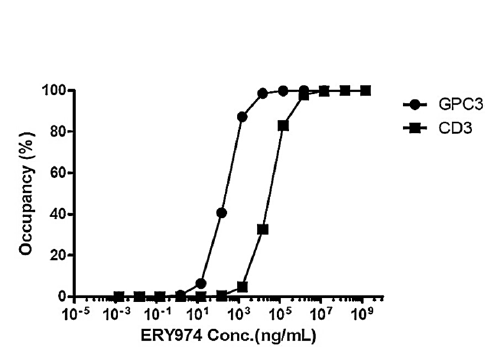
图5 ERY974的GPC3/CD3抗原受体占有率分析

食蟹猴模型在ERY974安全性评价中的适用性验证
通过表面等离子共振(结合亲和力分析)、功能活性测试(PBMCs细胞毒性和T细胞活化实验)及免疫组化(组织交叉反应性研究)等多维度实验,证实食蟹猴与人类在ERY974靶点结合特性、功能活性和组织分布上具有高度相似性,其特有的肾脏/卵巢结合位点更增强了模型预测价值,确证食蟹猴是评估ERY974安全性(包括NOAEL确定)的适用物种。

食蟹猴的单剂量研究中,ERY974的NOAEL为0.1μg/kg
研究团队通过食蟹猴单次给药实验评估ERY974的NOAEL,设置0.1、1和10 μg/kg三个剂量组(每组3雄3雌)。结果显示:10 μg/kg组出现短暂CRS症状(面部发红、发热、食欲减退),6天内缓解,伴IL-6显著升高及IL-2/IL-5/TNFα轻微上升;1 μg/kg组仅IL-6中度升高;0.1 μg/kg组无显著变化。

图6 食蟹猴ERY974安全性研究总结

根据MABEL和NOAEL方法的组合,FIH剂量确定为3ng/kg
通过MABEL方法计算得出ERY974的首个人体(FIH)剂量为4.9 ng/kg,该剂量是假设静脉输注4小时后预测的血浆峰浓度(Cmax)等同于细胞毒性试验中EC10值,结合异速生长模型法外推得到ERY974人体的 PK 参数计算得到的。
同时考虑到物种差异并采用0.1的安全系数,基于NOAEL方法计算的FIH剂量为3.2 ng/kg。综合MABEL和NOAEL两种方法的评估结果,研究团队最终确定3 ng/kg作为ERY974 I期临床试验的适宜起始剂量。

结合FDA对CD3双特异性抗体的FIH剂量选择建议
根据FDA在2017年发表的文章中建议,对于CD3双特异性抗体,FIH剂量选择应基于MABEL而非RO方法,同时推荐FIH剂量基于10%-30%PA。由于该类药物的作用机制复杂,RO数据难以准确预测临床活性,如案例中ERY974达到10% RO所需的浓度远超其体外活性(EC10),且肿瘤微环境中T细胞与靶细胞比例多变,RO方法可能导致剂量估算偏差。
而对于其他非CD3的免疫激活类双抗,FDA建议基于药理活性20%-80%PA是安全的,同时这类产品应用RO方法计算FIH剂量也可靠,回顾性研究证明20%-80%RO也是安全的。
PART 02
总结

CD3双抗的剂量选择(以ERY974为例)
根据FDA建议和实际案例研究,CD3双抗的FIH剂量选择遵循以下方法:
MABEL方法应用:
➢
计算得出ERY974的FIH剂量为4.9ng/kg;
➢
计算依据:
· 假设4小时静脉输注后的预测Cmax等于体外细胞毒性试验的EC10值;
· 采用异速生长模型法外推人体PK参数;
➢
该方法符合FDA推荐的基于体外活性数据(10%-30%PA范围)的原则。
NOAEL方法验证:
➢
计算剂量为3.2ng/kg;
➢
采用0.1的安全系数校正物种差异;
➢
虽然FDA指出NOAEL方法对CD3双抗的预测性有限,但仍可作为参考。
最终决策:
➢
综合MABEL和NOAEL结果;
➢
选择更保守的3 ng/kg作为I期临床起始剂量。

非CD3免疫激活双抗的剂量选择
与CD3双抗不同,这类产品的FIH剂量选择:
➢
可采用更宽的20%-80% PA范围;
➢
RO方法具有可靠性(20%-80% RO安全)。
PART 03
熙宁生物临床药理服务平台
熙宁生物临床药理服务平台,专注于创新药(涵盖生物大分子及小分子)的临床药理学研究,拥有丰富的项目经验和专业的技术能力。我们提供全方位的临床药理学服务,包括:
➢
PK NCA分析:采用WinNonlin软件非房室模型(NCA)计算PK参数,结合SAS和R等专业软件进行数据编程,确保分析结果精准可靠。
➢
实时分析支持剂量爬坡:通过实时数据分析,为SMC会议提供科学依据,优化临床试验设计。
➢
临床药理学研究设计与方案撰写:基于客户需求,定制化设计研究方案,确保科学性和合规性。
➢
完整PK/PD统计分析及CSR撰写:提供生物分析检测到统计分析报告生成的一站式服务,确保高效交付。
平台配备资深的临床药理专家、专业统计师及统计编程团队,能够对统计分析报告中的数据进行深度解读,提供专业的洞见和建议。我们严格按照CDISC标准进行统计编程,确保交付成果符合NMPA、FDA等国际监管机构的要求,助力药物快速通过审批。
PART 04
我们的优势
● 在生物大分子领域,我们拥有丰富的PK统计分析经验,涵盖 CAR-T细胞疗法、单抗、双抗、ADC(抗体药物偶联物)等药物类型,能够精准分析其非线性动力学特征、靶点介导的药物处置(TMDD)等特殊机制。
● 对小分子药物,我们深入分析其吸收、分布、代谢和排泄(ADME)特性,全面评估其药代动力学行为。
熟练使用 SAS 和 R 进行数据编程,生成高度定制化的高质量图表,相比 WinNonlin 的基础功能,R 和 SAS 在灵活性和可视化效果上更具优势,确保数据呈现清晰直观。
凭借高效的团队协作和先进的技术工具,我们能够快速响应客户需求,提供高效、精准的交付成果,助力药物研发加速推进。
参考文献:
[1] Komatsu SI, Kayukawa Y, Miyazaki Y, Kaneko A, Ikegami H, Ishiguro T, Nakamura M, Frings W, Ono N, Sakata K, Fujii T, Kishishita S, Kitazawa T, Endo M, Sano Y. Determination of starting dose of the T cell-redirecting bispecific antibody ERY974 targeting glypican-3 in first-in-human clinical trial. Sci Rep. 2022 Jul 19;12(1):12312.
[2] Saber H, Del Valle P, Ricks TK, Leighton JK. An FDA oncology analysis of CD3 bispecific constructs and first-in-human dose selection. Regul Toxicol Pharmacol. 2017 Nov;90:144-152.