



一、特应性皮炎
特应性皮炎(Atopic Dermatitis, AD),又称特应性湿疹,是一种典型的慢性炎症性皮肤疾病,其特征在于表皮屏障功能障碍和免疫改变。在过去几十年中,它在发达国家的发病率翻了一番,15%-30%的儿童和2%-10%的成人患有AD。
AD现有疗法多针对临床症状进行对症治疗,包括基于避免过敏原、使用保湿剂(润肤剂)和 局部/全身性皮质类固醇或免疫抑制剂等治疗方式,这些药物具有一定的副作用,并且疗效不持久,容易复发。目前AD尚无特异或靶向治疗。研究发现,AD的发病机制涉及到表皮屏障功能受损、皮肤炎症,如IL-13、IL-4、IL-31、IL33、IL-17、IL-23以及胸腺基质淋巴细胞生成素均参与AD的进展。随着研究的深入,基于对AD复杂表型及发病机制更多的了解,发现了许多新的潜在药物干预靶点,据报道目前在研的AD药物超过70多种1。由于AD疾病患病机制较复杂,尚需更多的理论研究和临床试验解析其致病脉络。转录组测序等基因组学技术因其在疾病研究、药物开发和疗效预测等方面的广泛应用,或可以在其中发挥重要的作用。
二、转录组分析的技术发展
在人类完成基因组计划后,转录组学、蛋白组学和代谢组学等不断涌现,生命科学的研究已经跨入后基因组时代。其中,转录组学作为率先发展起来的学科是研究细胞表型和功能的重要手段,同时是研究基因表达、基因结构和功能的一个新型的研究方向。
转录组(transcriptome)广义上指生物体细胞或组织在特定状态下所转录出来的RNA总和。大多数情况下转录组是狭义上的概念,即指信使RNA(mRNA)。mRNA通过编码蛋白质,负责将基因的遗传信息传递给行使生物学功能的蛋白质,与人类疾病发生关联更密切,更引人关注。
目前转录组研究技术主要包括微阵列芯片、实时荧光定量PCR(RT-PCR)以及高通量转录组测序(又称“RNA-Seq” )等。其中RNA-Seq具有通量高、灵敏度高、分辨率高等优势,同时与芯片法和RT-PCR相比,分析不受预设引物探针限制,可检测未知基因突变或识别新转录本等。
RNA-Seq测序可从整体水平上证明基因的功能和结构,揭示疾病中特定生物过程的分子机制和相关生物标志物。在过去的十几年中,RNA-Seq越来越多地用于AD研究。
三、RNA-Seq在AD分子机制研究中的应用
RNA-Seq广泛应用于AD的发病机制研究,尤其是相关免疫和炎症通路,如Th1、Th2、Th17、Th22细胞极化过程的转录组与AD疾病进展关系密切。为梳理AD发病机制的分子因素,以“特应性皮炎”、“Atopic Dermatitis”、“分子”、“基因”、“转录组”和“RNA-Seq”等为关键词检索文献,发现AD致病基因大致分为三类(表1),包括编码表皮结构蛋白及其抑制剂的屏障相关基因,以及先天性和适应性免疫反应通路相关基因2,3,4。
表1 AD相关基因
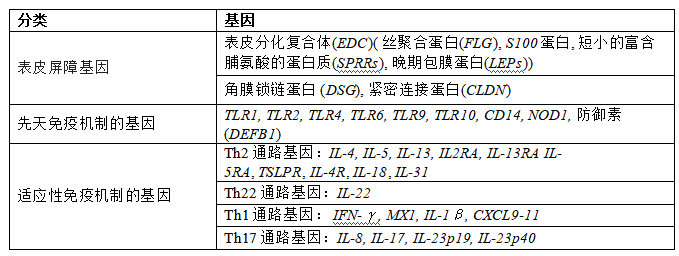
第一类:表皮发育和屏障功能相关基因。
表皮结构蛋白相关基因缺陷、表皮结构蛋白合成减少或结构功能改变和过敏原刺激等,均可致表皮屏障受损,进而引起机体免疫功能失常,导致全身性过敏性炎症。丝聚蛋白(FLG)缺陷是导致皮肤屏障功能缺陷的重要因素。Palmer等发现,在欧洲高加索人群中,FLG基因失活突变与近20%AD病例有关。此外,Gutowska-Owsiak D等5 6 7通过RNA-Seq等技术揭示表皮分化复合体(EDC)、CLDN蛋白、角蛋白(KRT)等同样与皮肤屏障损害有着密不可分的关系。
第二类:先天性免疫相关基因
皮肤上微生物群的多样性和过度生长由先天免疫系统感知和调节。调节剂抗菌肽(AMP)的失衡可能会导致皮肤微生物群多样性的丧失,金黄色葡萄球菌增加,进而刺激表皮持续产生炎症反应,导致皮肤屏障功能受损。
诸多致病因素致表皮屏障受损后,外源性变应原进入表皮,被皮肤树突状细胞(DCs)识别、呈递并诱导随后的T 细胞免疫反应,最终导致系统性过敏性疾病的发生(图1)。Oyoshi等通过RNA-seq发现,皮肤屏障功能受损后,受损区表皮角质形成细胞释放胸腺基质淋巴细胞生成素(TSLP) 8,后者激活DCs,刺激T细胞向Th2 等细胞的极化,引起过敏性炎症反应。
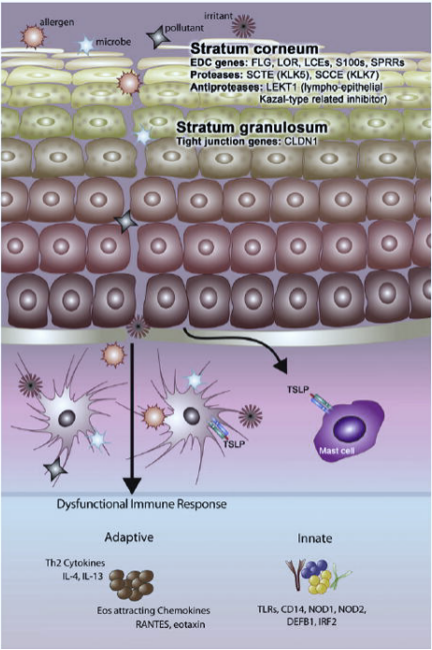
图1 AD遗传机制9
第三类:适应性免疫相关基因
一般观点认为,AD的发展主要依赖于Th2淋巴细胞驱动的炎症反应,其他 T 细胞亚群 (Th1、 Th17 和 Th22)起辅助作用。Julia K. Gittler等10通过RNA-seq、免疫组化等技术研究皮损组织的细胞因子表达情况,发现AD发病具有双向免疫模式,Th2 反应在急性期和慢性期AD 损伤中均居主导地位,Th1 细胞介导的炎症反应,在慢性AD 损伤中扮演重要角色。
其中,AD主要发病机制为皮损处Th2相关细胞因子如IL-4和IL-13、趋化因子如TARC(胸腺活化调节趋化因子)和嗜酸性粒细胞趋化因子等控制。IL-4和IL-13通过降低角质形成细胞终末分化、降低表皮屏障蛋白表达及增加TSLP,从而导致屏障功能障碍。此外,IL-4和IL-13可导致金黄色葡萄球菌等致病菌的定植增加,进而影响表皮屏障功能。
1999年Elias 11提出皮炎分子机制的“Outside-in”假说(图2),认为皮肤屏障受损早在AD 发病前就存在,是导致机体免疫失常的启动因素。表皮结构蛋白相关基因缺陷等引发表皮屏障受损,引起免疫功能失常和炎症发生。这就是AD 发病的遗传及获得性皮肤屏障功能失常假说。近些年有学者提出“Inside-out ”假说,认为先有免疫炎症,再有皮肤屏障功能失常。表皮屏障和免疫失常的前后顺序目前无法定论,精确作用机制尚需更多证据的指出。
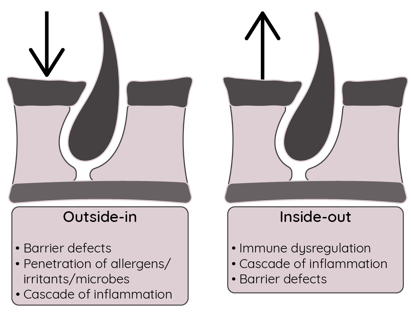
图2 AD发病机制之“Outside-in”和“Inside-out”假说
熙宁生物现推出RNA-Seq测序服务,可全面分析组织、血液、石蜡包埋切片(FFPE)等样本的mRNA表达情况,进行基因差异表达分析、差异基因功能和通路注释、可变剪切变异分析和新转录本预测分析等,出具完整全面的实验结果报告,助力申办方开展药物作用机制研究和生物标志物研究。熙宁生物采用KAPA建库试剂进行mRNA富集和文库构建,保证文库质量和数据的稳定性,配备CN500测序仪完成上机测序,可在5个工作日内完成样本分析全流程。
1.实验技术路线
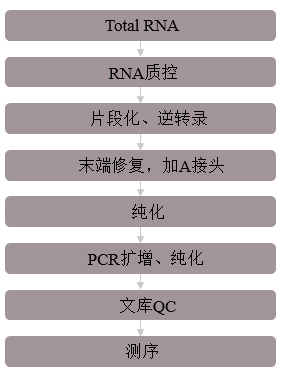
2.生信技术路线
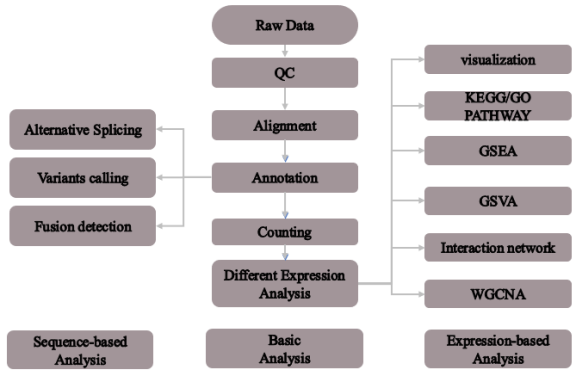
3.性能展示
(1)准确度/精密度
将RNA标准品Spike-in至皮肤组织total RNA,进行3批RNA-Seq检测,结果均与预期相符,9个差异表达基因可100%检出(红色圆点)。
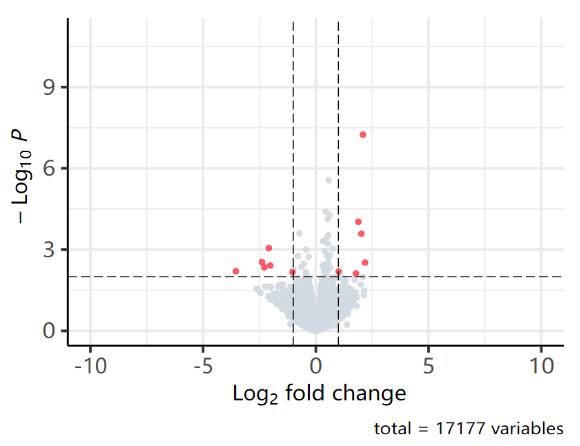
阈值设置:|Log2fold change|≥1,p<0.05
图3 RNA标准品RNA-Seq测序的火山图
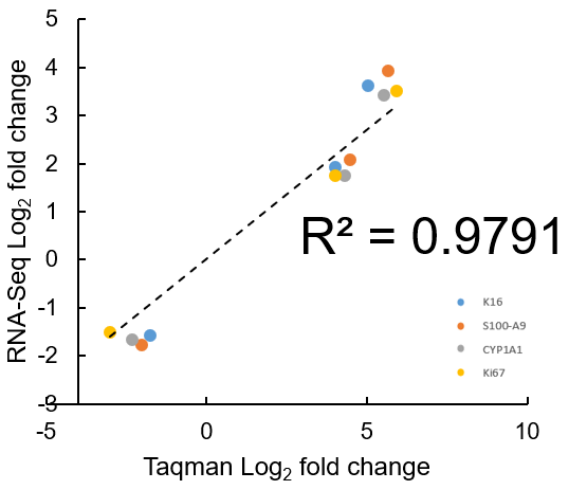
(2)准确度
RNA-Seq与qPCR(Taqman探针法)结果符合度高,R2>0.9700。
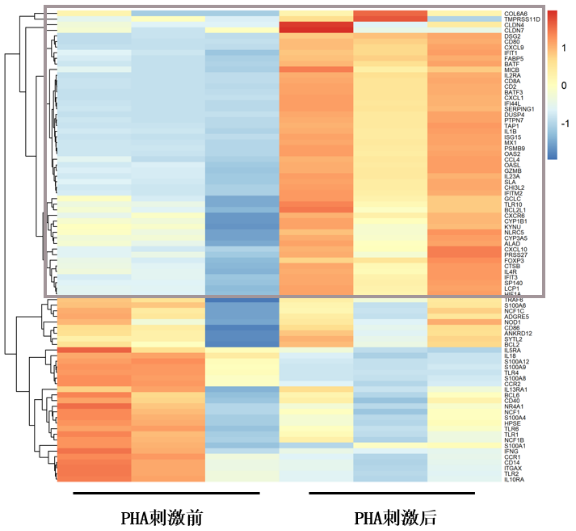
(3)案例展示
植物血凝素(PHA)刺激导致T细胞增殖,将引起相关细胞因子的表达。根据mRNA表达图谱,部分T细胞增殖相关mRNA显著上调(方框),与预期相符。
参考文献
1. Bieber T. Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov. 2022;21(1):21-40. doi:10.1038/s41573-021-00266-6
2. Bin L, Leung DYM. Genetic and epigenetic studies of atopic dermatitis. Allergy, Asthma Clin Immunol. 2016;12(1):1-14. doi:10.1186/s13223-016-0158-5
3. Nedoszytko B, Reszka E, Gutowska-Owsiak D, et al. Genetic and epigenetic aspects of atopic dermatitis. Int J Mol Sci. 2020;21(18):1-18. doi:10.3390/ijms21186484
4. Ghosh D, Ding L, Sivaprasad U, et al. Multiple transcriptome data analysis reveals biologically relevant atopic dermatitis signature genes and pathways. PLoS One. 2015;10(12):1-23. doi:10.1371/journal.pone.0144316
5. Gutowska-Owsiak D, Salimi M, Selvakumar TA, Wang X, Taylor S, Ogg GS. Histamine exerts multiple effects on expression of genes associated with epidermal barrier function. J Investig Allergol Clin Immunol. 2014;24(4):231-239.
6. Gutowska-Owsiak D, Schaupp AL, Salimi M, et al. IL-17 downregulates filaggrin and affects keratinocyte expression of genes associated with cellular adhesion. Exp Dermatol. 2012;21(2):104-110. doi:10.1111/j.1600-0625.2011.01412.x
7. Gutowska-Owsiak D, Schaupp AL, Salimi M, Taylor S, Ogg GS. Interleukin-22 downregulates filaggrin expression and affects expression of profilaggrin processing enzymes. Br J Dermatol. 2011;165(3):492-498. doi:10.1111/j.1365-2133.2011.10400.x
8. Oyoshi MK, Larson RP, Ziegler SF, Geha RS. Mechanical injury polarizes skin dendritic cells to elicit a TH2 response by inducing cutaneous thymic stromal lymphopoietin expression. J Allergy Clin Immunol. 2010;126(5):976-984.e5. doi:10.1016/j.jaci.2010.08.041
9. Barnes KC. An update on the genetics of atopic dermatitis: Scratching the surface in 2009. J Allergy Clin Immunol. 2010;125(1-3):16-29.e11. doi:10.1016/j.jaci.2009.11.008
10. Gittler JK, Shemer A, Suárez-Fariñas M, et al. Progressive activation of TH2/TH22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol. 2012;130(6):1344-1354. doi:10.1016/j.jaci.2012.07.012
11. Elias PM, Wood LDC, Feingold KR. Epidermal pathogenesis of inflammatory dermatoses. Am J Contact Dermat. 1999;10(3):119-126. doi:10.1016/S1046-199X(99)90054-4