



随着新药研发的靶点越来越新,创新药研发从Fast Follow到First in Class, Best in 、Class大步调迈进,新兴靶点的药物实体在临床早期是否能够看到有效性的信号是需要迫切回答的问题,也是药物研发企业决定该药是否进入临床Ⅱ期进行风险控制的重要决策因素。国家药品监督管理局药品审评中心密集发布《模型引导的药物研发技术指导原则》,《以患者为中心的临床试验设计技术指导原则》,《以临床价值为导向的抗肿瘤药物临床研发指导原则》等指导性文件,这也要求新药研发企业在临床早期提供药物有效性相关的数据来支撑新药进入ⅡⅢ期临床,保护临床受试者的权益,提高临床公共医疗资源配置效率。在临床Ⅰ期进行药物药理药效生物标志物检测是回答上述问题,来满足监管需求的最佳技术解决路径。本文将药效学生物标志物的临床应用,生物分析内容和策略,以及临床生物分析案例对药效生物标志物的临床检测进行阐述。
美国的NIH对药效生物标志物有一个非常恰当的定义1,翻译下来如下:
药效学(PD)生物标志物是药物作用于生物体内靶点的效应分子指标。PD生物标志物可用于检验临床给药方案、靶标效应和肿瘤生理学响应之间的联系。在新药开发阶段重点PD生物标志物测量可提供关键数据,以做出明智的、早期的继续/不继续决策,选择合理的靶向药物组合,并优化联合药物方案等。鉴于药效需学生物标志物在靶向治疗药物研发中的关键作用,经过验证和可靠的临床PD检测方法是必要的。
药效生物标志物大致主要有两种临床应用:
一、早期研究中尚无法确定与临床结果最相关的药效学生物标志物时,可将多个药效学生物标志物以及药代动力学特征相结合,为R2PD剂量选择提供重要依据。例如,在布鲁顿氏酪氨酸激酶(BTK)抑制剂的开发过程中,BTK靶点占有率,可作为选择临床推荐剂量和给药方式的重要依据2。在模型引导的药物研发(MIDD)中,药效学生物标志物是建模和分析的核心因素。
二、用与临床结局建立明确相关性的药效学生物标志物作为替代终点,缩短研发周期,使有效的药物更早惠及患者。比如生存期延长是肿瘤药物研发中反映临床获益的金标准,因此在抗肿瘤药物临床试验中,通常采用反映生存获益的指标总生存时间(OS)或被证实与OS相关的替代终点(如无进展生存时间)作为主要终点支持监管决策。采用上述终点时,往往研究周期较长。
在创新药物临床研发前沿,多采用药效生物标志物结果,结合药代动力学特征数据,用于R2PD剂量选择或者跟监管机构进行沟通,可作为药物有效性的重要依据。基于临床Ⅰ期的药效生物标志物数据进行Ⅱ期临床决策,是对Ⅰ期看安全性和最大药物耐受,Ⅱ期看有效性等教科书式刻板印象的挑战,也是药物从化疗药物到靶向药物迭代的智慧选择。
从生物分析临床实践角度,药效生物标志物以待检测标志物是否能够拿到合适的标准品物质可分为两类:定量型生物标志物和非定量型生物标志物。定量型和非定量型药效生物标志物的方法学开发难度,方法学开发和验证内容有着较大的差异,需要区别进行对待。
定量型药效生物标志物的分析策略:
定量型药效生物标志物通常能够通过蛋白重组技术在体外表达标准品物质,基于标准品物质的标准曲线对临床样品的生物标志物在检测体系中的信号值进行浓度的回算预测,通常临床检测样品为血清、血浆,脑脊液等液体基质,采用ELISA/MSD等LBA方法进行检测。定量型药效生物标志物的方法学开发和验证过程大体可参考抗体药物PK检测的技术路径如《ICH M10:生物分析方法验证及样品分析》,需要进行精密度,准确度,灵敏度,稀释线性等方法学验证。但也有一些区别,关键点在于需要在方法学开发和验证阶段,考察检验检测体系中标准物质和样品的待测物质是否有了类似的剂量曲线,需要进行平行性和选择性检验,如图1。平行性和选择性检验内容可参考笔者写的另一篇文章3,在此不做详述。
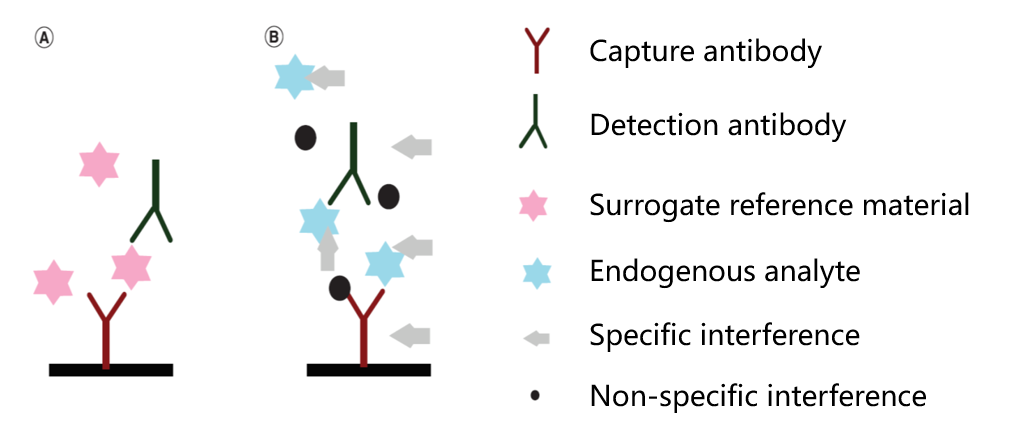

图1. 定量型生物标志物平行性和选择性验证内容
非定量型药效生物标志物的分析策略:
非定量型药效生物标志物通常拿不到标准品物质,需要基于检测的信号值进行药效生物标志物的强度表征,存在较大的批间差异。该类型的药效标志物临床样品通常为人体肿瘤组织或者全血PBMC等,采用IHC,流式,LBA,细胞学等方法进行检测。非定量型药效生物标志物检测方法多样,通常为用药前后细胞胞内或者胞外膜蛋白表达丰度,受体占位,胞内磷酸化蛋白,甲基化蛋白等指标的变化情况作为检测对象,具备功能学检测特征。如下图2。某合成致死抑制剂存在的几种临床药效生物标志检测方式,以及优劣如下:
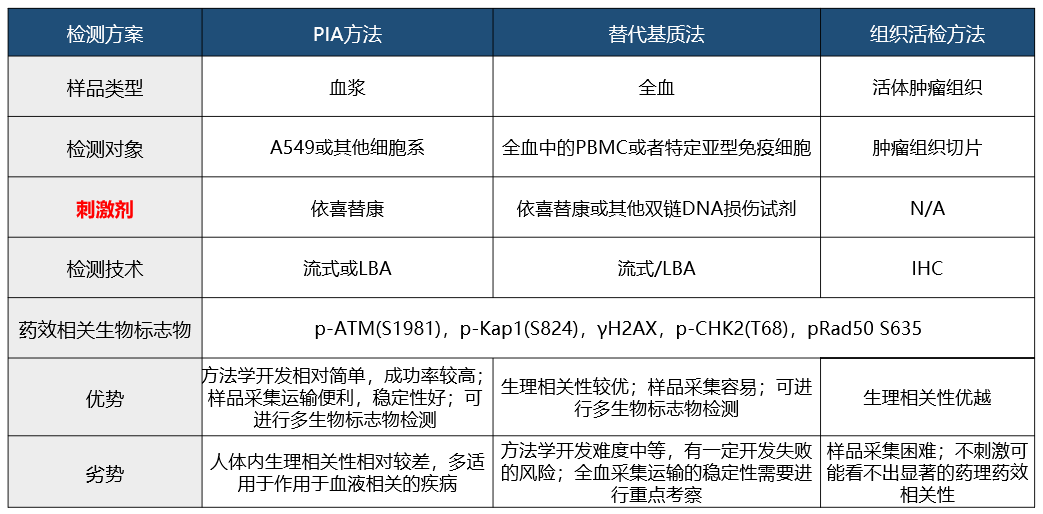
图2. 非定量型生物标志物临床检测路径
在制定药效学生物标志物检测方案前,需要对定量型药效生物标志物和非定量型生物标志物进行合理区分。非定量型生物标志物检测多为功能学检测,其方法具有难度较大,检测技术路径不明确,模式不固定,样品稳定性较差等特点,因此需要较长的方法学开发周期和强大的方法学开发技术能力,在临床样品分析阶段如果方法学开发和验证没有做好,很可能会出现药物浓度和药效学生物标志物变化不明显,甚至反转的情形,风险较大。
非定量型药效生物标志物方法学开发难度较大,因此需要基于药物作用机理,生物标志物生理学特征,临床样品可及性,以及方法学参数性能等多方面进行考量,从而制定合适的分析策略。
部分示例如下:
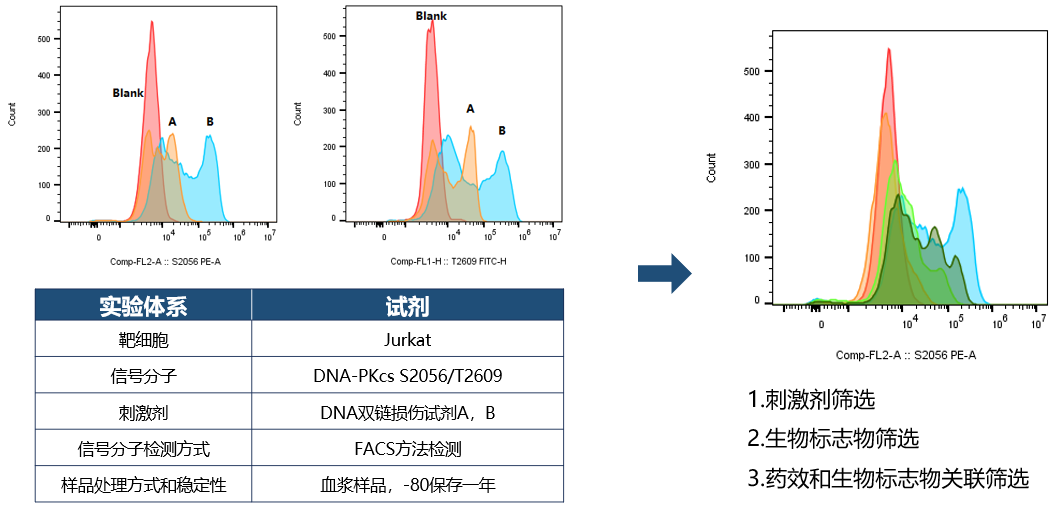
基于血浆基质的PIA检测方法
采用刺激剂A和B刺激Jurkat的细胞系,检测不同的药效生物标志物的刺激效果和方法学信号窗口,选择合适的检测体系。基于血浆中药物在检测体系中和药效生物标志物的药效相关性选择合适的刺激剂,生物标志物等实验条件进行临床样品的药效生物标志物分析。
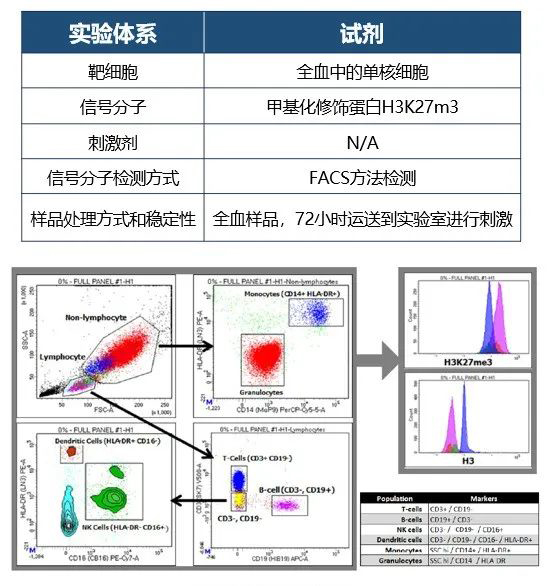
基于PBMC基质的流式检测方法
基于全血PBMC的免疫分型,以及药物在特定细胞亚群中翻译后修饰蛋白的药效相关性建立流式检测体系。采用特定细胞亚群的检测方法相对于采用PBMC裂解MSD检测方法,有更佳的信号窗口,方法学稳固性以及药效相关性。
基于PBMC裂解液的ELISA方法
采用PAR标准物质,肿瘤细胞系,PBMC,全血PBMC逐层推进的方法优选出合适的针对全血样品裂解液中PAR(poly ADP-ribose)的特异性抗体对,以及建立药物和PAR(poly ADP-ribose)的药效相关性性检测体系,有优于试剂盒的性能。
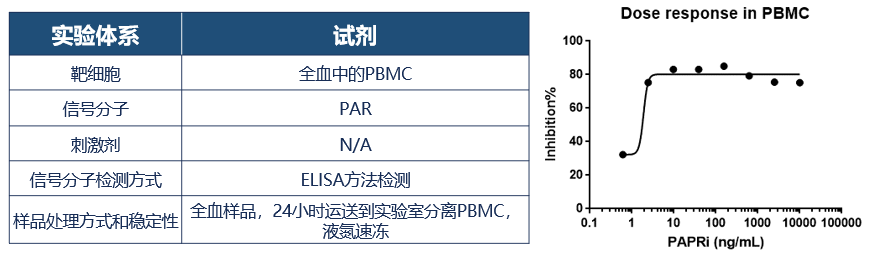
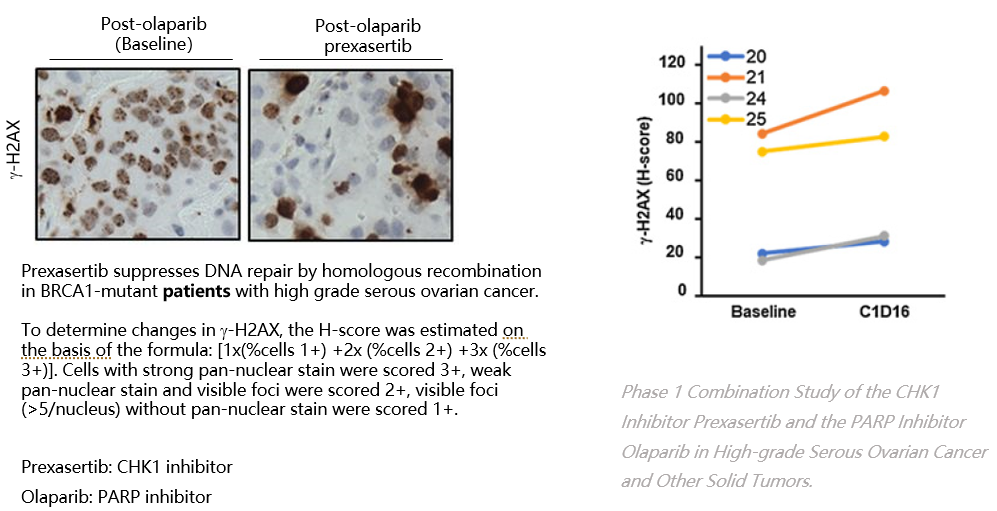
基于肿瘤组织的IHC方法
采用筛选的γH2AX特异性抗体,进行用药前后肿瘤组织的γH2AX免疫组化染色,建立药物用药剂量和γH2AX的药效相关性。
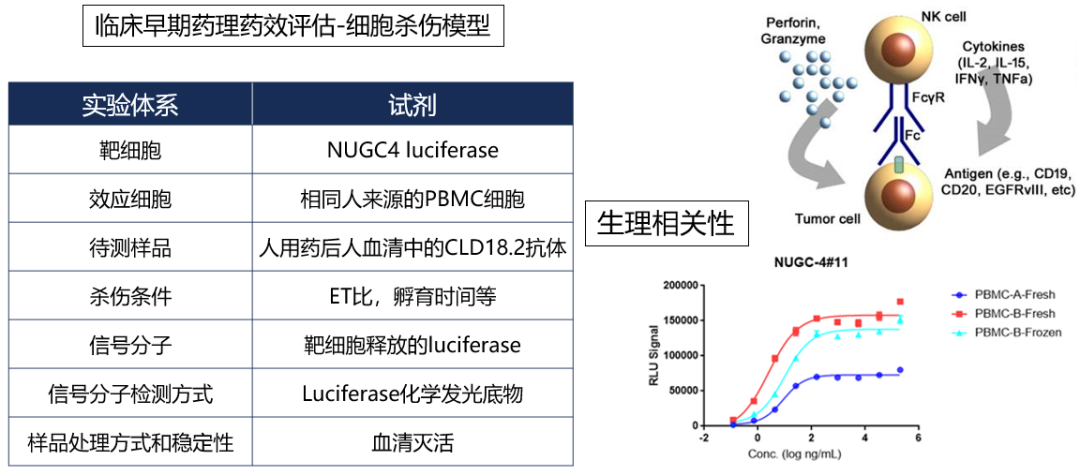
基于血清基质的抗体药物ADCC功能
构建NUGC4 luciferase单克隆细胞系,优化PBMC和NUGC4 luciferase单克隆E:T比,建立稳固的基于血清样品的抗体药物介导的ADCC功能检测体系,检测窗口可达50倍,方法学稳固。
药效学生物标志物的临床生物分析策略需要基于药物作用机理,生物标志物生理学特征,临床样品可及性和稳定性,以及方法学参数性能等多方面进行考量,制定不同的分析策略。熙宁生物|精翰生物由多位博士组成的转化医学团队可进行特定药效学方法的方案设计与评估,目前也已有完备的功能学检测方法库,可进行临床药效相关性模型的搭建和药效生物标志物的筛选探索工作,可优化组合最适宜的方法学条件和药效标志物,确保临床药效生物标志物检测的方法学性能。
熙宁生物|精翰生物有齐全的技术平台和专业化的团队专注于临床药理药效学生物分析领域,对于预期难度较高的检测项目可同时进行多技术平台(IHC,流式,LBA和qPCR等)的方法学开发,优选检测方法进行方法学验证。目前已积累了丰富的临床阶段药效学实战经验,包括100+定量药效生物标志物和50+非定量药效生物标志物方法学开发,验证和样品分析,可基于临床采集运输前处理检测的全生命周期流程进行方法学开发和验证,,欢迎咨询交流。
参考文献:
[1].https://next.cancer.gov/developmentresources/pd_biomarker.htm
[2].Bilal Tariq, Ying C. Ou, Jennifer C. Stern, Vaibhav Mundra, Nicole Wong Doo, Patricia Walker, Katharine L. Lewis, Chester Lin, William Novotny, Srikumar Sahasranaman, Stephen Opat. (2023) A phase 1, open-label, randomized drug–drug interaction study of zanubrutinib with moderate or strong CYP3A inhibitors in patients with B-cell malignancies. Leukemia & Lymphoma 64:2, pages 329-338.
[3].生物标志物方法质量和方法验证参数关联的深度解析(1)