



玫瑰痤疮(Rosacea),常被称为酒渣鼻,是一种常见的慢性炎症性皮肤病,全球患病率为1%~20%[1]。主要累及面部中央(尤其是面颊、鼻翼、前额、下巴),以皮肤潮红、毛细血管扩张、丘疹、脓疱为典型表现,部分患者可伴随皮肤干燥、灼热或刺痛感。其发病机制复杂,临床分型明确,治疗需根据病情严重程度个体化制定[2]。
玫瑰痤疮主要分为四个亚型:红斑毛细血管扩张型(ETR),表现为面部中央持续性红斑与毛细血管扩张;丘疹脓疱型(PPR),表现为面部持续性红斑,伴丘疹与脓疱;增生型(PhR),以皮肤增厚、表面质地不规则为特征;以及眼型 [2]。该病如果不及时治疗,会显著影响患者的自尊与心理健康,且与高血压、炎症性肠病、自身免疫性疾病、偏头痛等全身性疾病相关 [3]。
PART 01
发病机制
目前研究表明,玫瑰痤疮的发病机制主要与遗传因素和环境因素的相互作用有关,具体涉及免疫功能异常、慢性炎症、微生物失衡及血管神经功能障碍等。近期研究已明确玫瑰痤疮发病中的关键信号通路,其中Toll样受体2(TLR2)、LL37蛋白的产生、白细胞介素 17(IL-17)信号通路,以及 LL37-雷帕霉素哺乳动物靶点(mTOR)信号通路、Janus激酶-信号转导与转录激活因子(JAK-STAT)信号通路的作用备受关注。LL37相关的信号通路,特别是涉及TLR2和mTORC1,在玫瑰痤疮的发病机制中至关重要。这些发现对开发靶向治疗方案具有重要意义[4][5][6][7]。
如图1所示[8],该图展示了LL37介导的关键通路及其在玫瑰痤疮发病机制中的作用,强调了不同细胞类型和信号分子之间的复杂相互作用。LL37与多个关键分子相互作用,包括TLR2、雷帕霉素复合物1靶点(mTORC1)、趋化因子(C-X-C基元)配体8(CXCL8)和与瞬时感受器电位香草酸受体4 (TRPV4)相连的Mas相关G蛋白偶联受体成员X2(MRGPRX2)。这些相互作用导致各种细胞类型的激活,如巨噬细胞、中性粒细胞、T细胞、肥大细胞、浆细胞样树突状细胞(pDCs)和血管内皮细胞。这些细胞的激活导致细胞因子的产生,释放包括TNF-α、IL-6、IL-1β、C基序趋化因子配体(CCL)5、CXCL9和CXCL10,在酒渣鼻的炎症、免疫调节和血管生成中起关键作用。
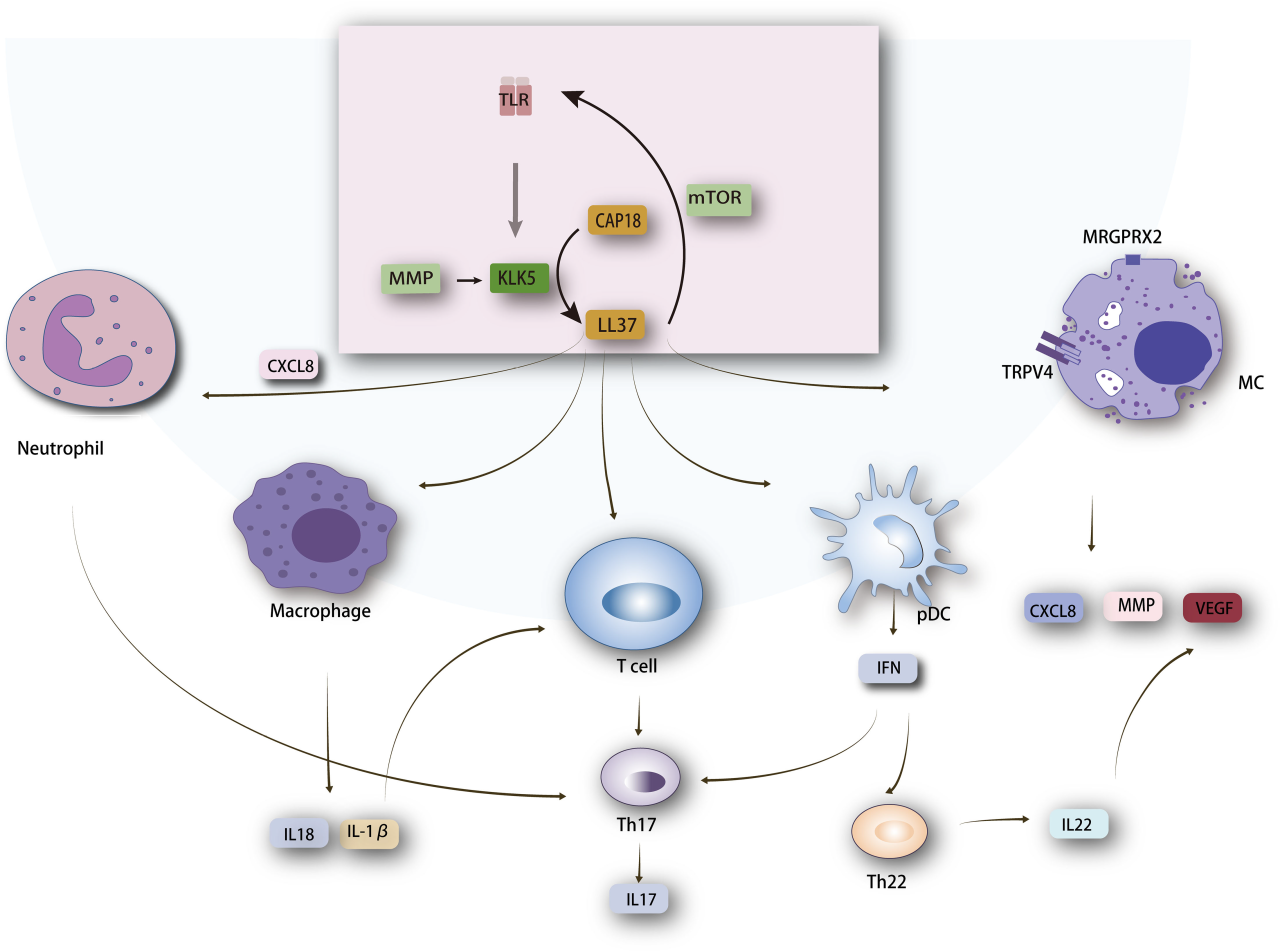
图1 LL-37在酒渣鼻发病中的作用机制
PART 02
LL37诱导的玫瑰痤疮小鼠模型
选用6-8周龄的雄性BALB/c小鼠,提前24小时将小鼠背部毛发剔除干净,皮内注射40 μL LL37 (320 μM),每天2次,连续造模20天,拍照记录皮肤玫瑰痤疮的发病过程,并根据皮肤红肿程度进行临床评分[9][10]。

图2 实验计划
PART 03
关键数据

体重变化
如图3所示,LL37造模后小鼠体重有明显下降,后续体重逐渐恢复并趋于稳定,动物状态良好。
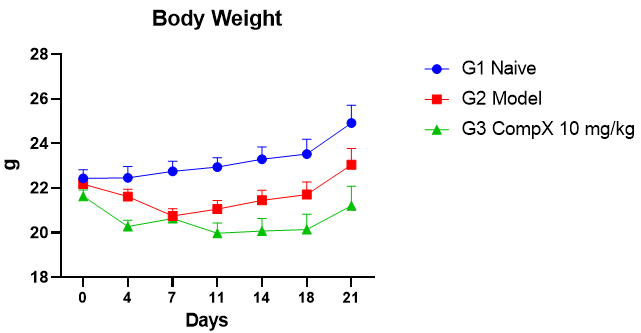
图3 小鼠体重变化

临床评分
如图4和图5所示,LL37诱导后,小鼠背部临床评分逐渐增加,在10天左右达到峰值,药物干预可以显著降低临床评分[11]。
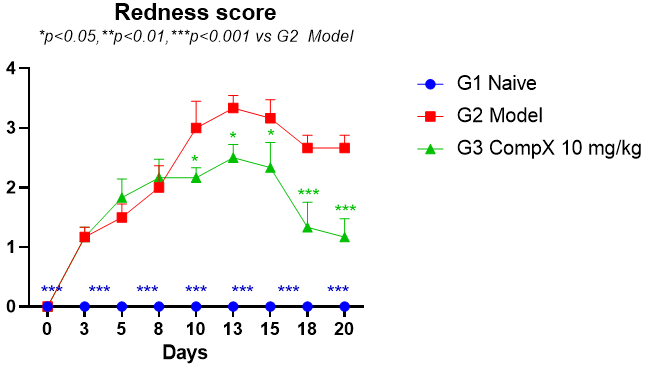
图4 临床评分
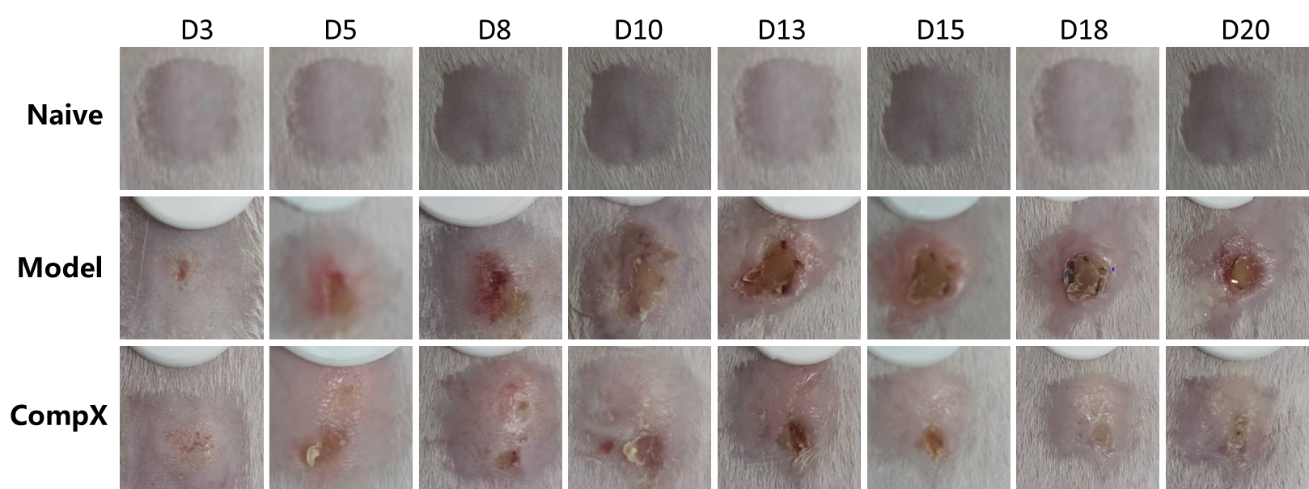
图5 玫瑰痤疮染色代表图片

皮肤厚度
如图6和图7所示,LL37造模组小鼠皮肤炎症浸润明显,小鼠皮肤厚度显著增加,药物干预组炎症浸润明显减少,皮肤厚度显著降低。
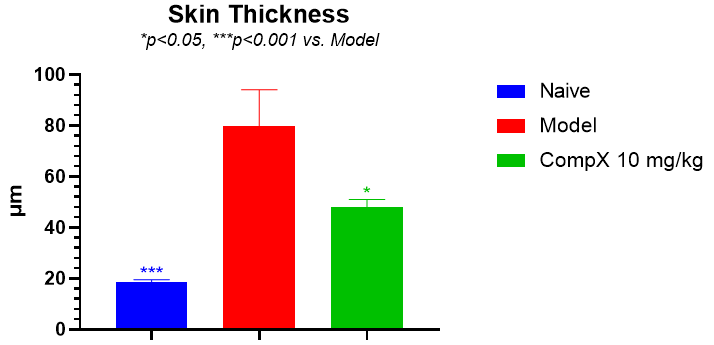
图6 小鼠皮肤厚度
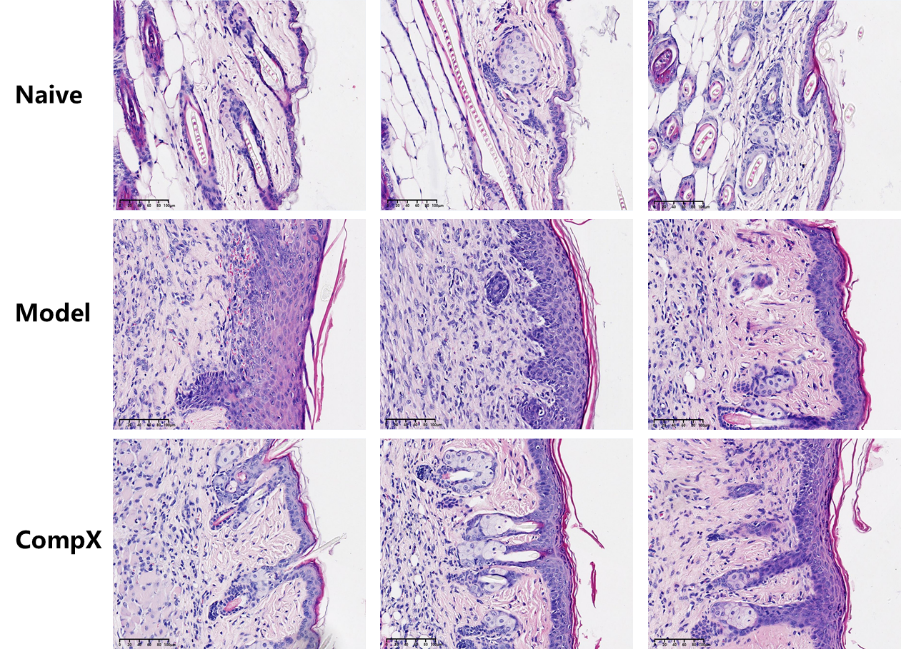
图7 皮肤HE染色代表性图片
LL37诱导的小鼠玫瑰痤疮模型中,皮肤临床评分、皮肤组织中炎症浸润显著、皮肤厚度增加,较好地模拟临床患者的病理表现,与文献报道基本一致。药物干预20天后,可以显著降低上述指标,改善玫瑰痤疮症状,表明该模型可用于评估药物对于玫瑰痤疮的治疗效果。
在炎症和自身免疫疾病领域,熙宁生物|精翰生物临床前药理部门已经建立了完善的动物模型库(200+),可以为客户提供丰富的药物评价动物模型,包括炎症和自免疾病(皮肤疾病、关节炎、多发性硬化、红斑狼疮、葡萄膜炎、肠炎等)、纤维化(肺纤维化、肝纤维化、皮肤纤维化、肾纤维化)、肺部疾病(肺纤维化、哮喘、过敏性鼻炎、急性肺损伤 )、代谢系统疾病(NASH、肥胖、糖尿病肾病、肝纤维化)、肾脏疾病模型(急性肾损伤、慢性肾损伤、肾纤维化、糖尿病肾病、IgA肾病)、疼痛(炎性疼痛、神经性疼痛、偏头疼、术后疼痛、关节疼痛、骨痛)、神经退行性疾病(AD、PD)。在重点聚焦炎症和自身免疫疾病领域的同时,也可根据客户需求,提供相应的模型定制服务。若您有相关需求,欢迎拨打 021 - 50833588 转 532 与我们联系~
参考文献:
[1] Gether L, Overgaard LK, Egeberg A, Thyssen JP. Incidence and prevalence of rosacea: a systematic review and meta-analysis. Br J Dermatol. 2018;179(2):282-289.
[2] Two AM, Wu W, Gallo RL, Hata TR. Rosacea: part I. Introduction, categorization, histology, pathogenesis, and risk factors. J Am Acad Dermatol. 2015;72(5):749-760.
[3] Holmes AD, Spoendlin J, Chien AL, Baldwin H, Chang ALS. Evidence-based update on rosacea comorbidities and their common physiologic pathways. J Am Acad Dermatol. 2018;78(1):156-166.
[4] Alia E, Feng H. Rosacea pathogenesis, common triggers, and dietary role: The cause, the trigger, and the positive effects of different foods. Clin Dermatol. 2022;40(2):122-127.
[5] Buhl T, Sulk M, Nowak P, et al. Molecular and Morphological Characterization of Inflammatory Infiltrate in Rosacea Reveals Activation of Th1/Th17 Pathways. J Invest Dermatol. 2015;135(9):2198-2208.
[6] Hua P, Tu Y, Yang Z, et al. Minocycline inhibits rosacea-like inflammation through the TLR4-mediated NF-κB signaling pathway in vivo and in vitro. PLoS One. 2025;20(5):e0323598.
[7] Zeng B, Yang Z, Jiang G, et al. Dendrobium polysaccharide (DOP) ameliorates the LL-37-induced rosacea by inhibiting NF-κB activation in a mouse model. Skin Res Technol. 2024;30(1):e13543.
[8] Yang F, Wang L, Song D, et al. Signaling pathways and targeted therapy for rosacea. Front Immunol. 2024;15:1367994.
[9] Zhang C, Kang Y, Zhang Z, et al. Long-Term Administration of LL-37 Can Induce Irreversible Rosacea-like Lesion. Curr Issues Mol Biol. 2023;45(4):2703-2716.
[10] Kim M, Kim KE, Jung HY, et al. Recombinant erythroid differentiation regulator 1 inhibits both inflammation and angiogenesis in a mouse model of rosacea. Exp Dermatol. 2015;24(9):680-685.
[11] Meng X, Li Y, Wang F, et al. Quercetin attenuates inflammation in rosacea by directly targeting p65 and ICAM-1. Life Sci. 2024;347:122675.