



MET(c-MET,cellular-mesenchymal epithelial transition factor),即细胞间质上皮转化因子,是受体酪氨酸激酶家族的重要成员,参与调控细胞生长、分化、迁移和侵袭等多个生物学过程。作为继EGFR和ALK之后在非小细胞肺癌中的关键驱动基因,MET的异常激活与肿瘤的发生发展密切相关。本文将从MET蛋白的结构与信号通路、变异类型、表达特征、IHC检测方法及判读标准等方面系统介绍其在肿瘤诊疗中的临床价值。
PART 01
MET蛋白结构及信号通路
MET基因最早于1984年在研究肝细胞生长因子(HGF)受体时被发现,最初被称为c-Met或HGFR(肝细胞生长因子受体)[1]。该蛋白由约1390个氨基酸组成,分子量约190 kDa,是一种典型的跨膜蛋白,其结构包括:细胞外配体结合区(含Sema、PSI和Ig-like结构域)、跨膜区以及细胞内酪氨酸激酶结构域[2]。
肝细胞生长因子(HGF)作为MET的唯一已知配体,与MET结合后可诱导受体二聚化及自磷酸化,尤其激活Y1234/Y1235和Y1349/Y1356等关键酪氨酸残基,进而募集包括GRB2、GAB1、SHC等在内的多种衔接蛋白,启动下游多条信号通路,如RAS–MAPK、PI3K–AKT、STAT3和NF-κB等。这些通路共同调控细胞的增殖、存活、迁移、侵袭及血管生成等生物学过程[3]。
在正常情况下,HGF/MET信号参与胚胎发育和组织修复;然而其异常激活(如通过突变、扩增或过表达)则与多种癌症的发生、发展及不良预后密切相关。

图1 MET蛋白的结构及下游信号通路
PART 02
MET的变异形式与临床检测策略
MET异常包括MET突变(主要为14号外显子跳跃突变和MET激酶结构域突变)、MET基因扩增、MET基因融合及MET蛋白过表达等,均可能导致MET信号通路的异常激活,从而引起肿瘤的发生发展[4]。
在非小细胞肺癌(NSCLC)中,MET不同类型异常形式的发生机制及其临床意义存在差异,其中目前临床实践主要关注的是MET 14号外显子跳跃突变、MET基因扩增和MET蛋白过表达[5]。这些异常形式的检测需依托不同技术平台:METex14跳跃突变推荐采用RT-PCR或RNA-based NGS以提高检出率;基因扩增以FISH为金标准,可准确区分多倍体与焦点性扩增;而MET蛋白过表达则主要依靠免疫组化(IHC)进行半定量评估,其经济、快速的特点尤其适用于临床初筛和大样本检测。
值得关注的是,MET蛋白过表达与基因水平变异并非完全一致。TATTON和SAVANNAH这两项重要的临床研究为我们提供了直接证据(图2)。在TATTON研究中,虽然MET蛋白过表达(≥50%肿瘤细胞强着色)与MET基因扩增(MET GCN≥5或MET/CEP7≥2)存在一定重叠,但并非完全一致,表明有一部分仅存在蛋白过表达的患者群体[6]。SAVANNAH研究的数据更为清晰地揭示了这种不一致性:当使用更严格的阈值(即≥90%肿瘤细胞强着色定义为MET过表达,MET GCN≥10定义为MET扩增)时,仅有约15%的患者同时满足这两个条件;而有约14%的患者存在高水平MET蛋白过表达但未达到高水平MET基因扩增[7]。
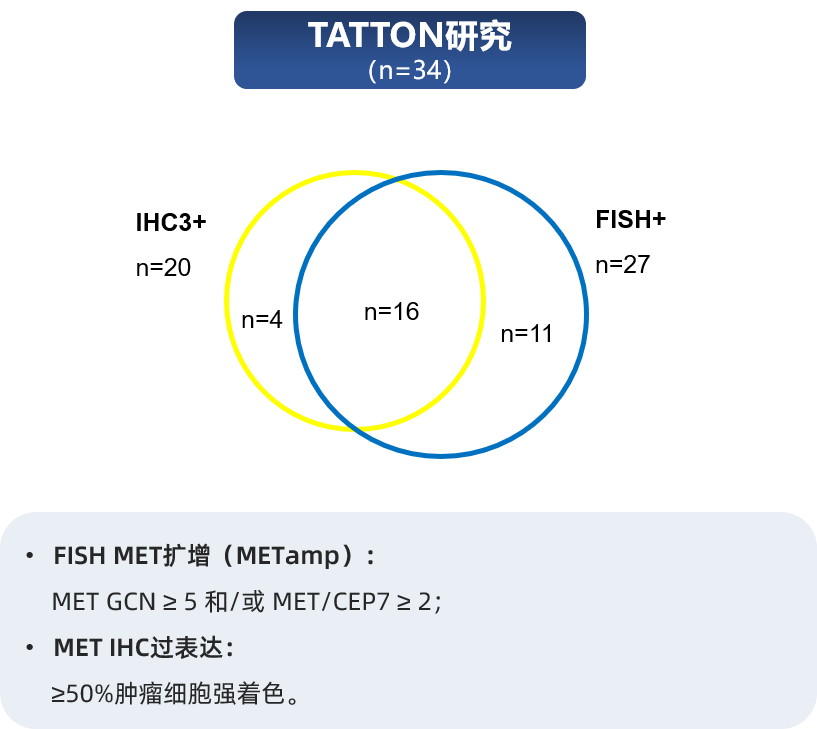
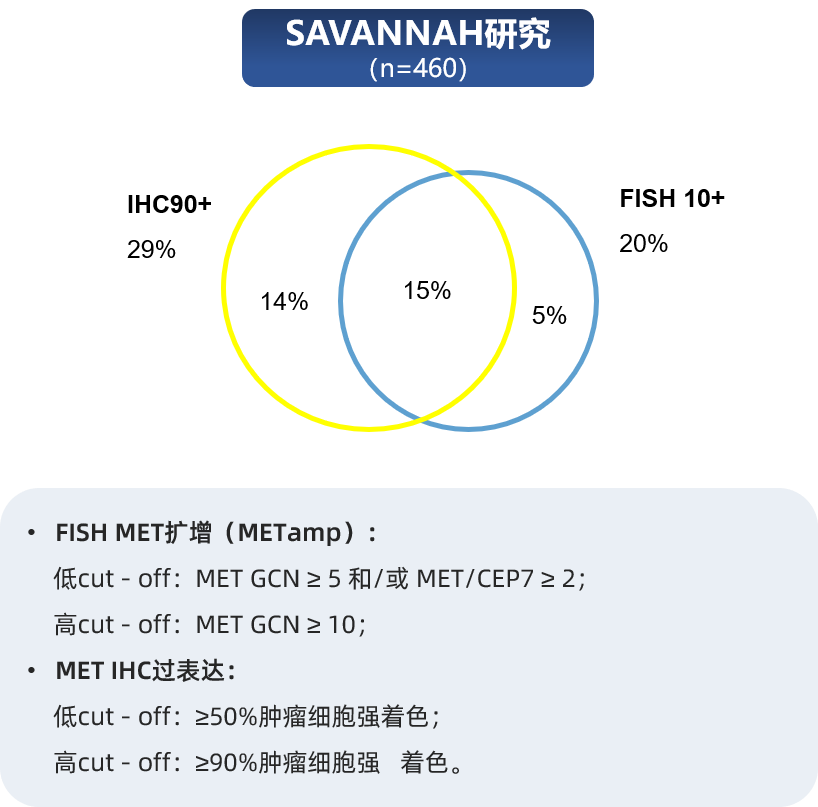
图2 MET蛋白过表达与MET基因扩增的相关性
这种不一致性具有重要的临床价值。它意味着,在MET基因扩增检测为阴性的患者中,仍可能存在MET蛋白的过表达。这部分患者很可能成为EGFR-TKI联合MET抑制剂靶向治疗的潜在获益人群,其疗效正是由IHC所检测到的蛋白过表达所驱动。这解释了为何IHC检测本身能够作为一个有效的生物标志物来筛选患者,而不仅仅依赖于FISH或NGS等基因检测方法。事实上,在 TATTON[7] 、SAVANNAH[6]、INSIGHT[8] 、NCT01610336[9]等多项临床研究中,IHC作为MET过表达检测方法已被列为入组标准之一。
因此,系统评估MET在不同层次的变异形式对于全面识别获益人群、制定精准治疗策略至关重要。其中,免疫组化作为检测MET蛋白过表达的核心手段,在临床实践和药物研发中正发挥着日益重要的作用。
PART 03
MET在实体瘤中的表达及预后
MET信号通路的异常激活广泛存在于多种实体瘤中,其过表达与肿瘤的恶性进展及不良预后密切相关。在非小细胞肺癌(NSCLC)中,MET蛋白过表达的发生率约为17.5%~63.7%[10-12],一项最新的系统回顾与Meta分析证实,MET蛋白过表达与非小细胞肺癌患者的总生存期(OS)及无进展生存期(PFS)缩短显著相关,是其独立的预后不良因素(图3)[13]。在胃癌(GC)中,约24%–82%的患者存在MET过表达,且研究发现MET过表达胃癌患者与较差的总生存相关,提示MET可能是胃癌患者的潜在治疗靶点[14]。
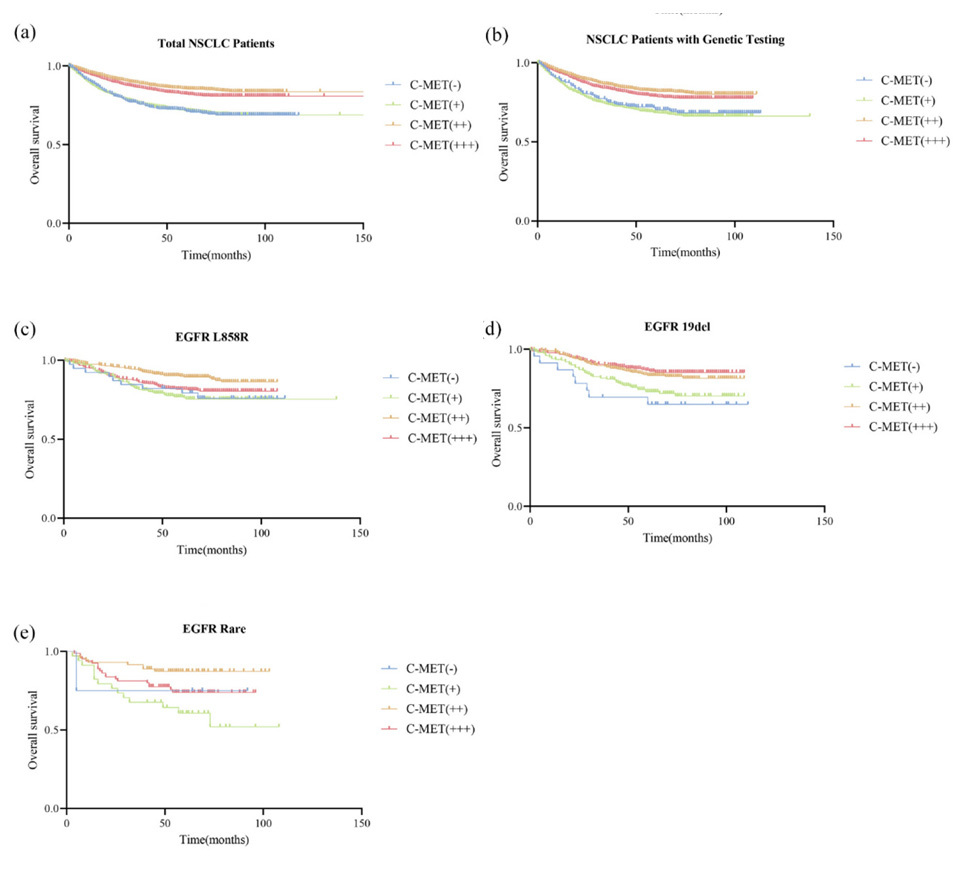
图3 不同C-MET IHC染色状态与OS的关系
除肺癌和胃癌外,MET的异常表达也在肝细胞癌、三阴性乳腺癌、肾细胞癌、结直肠癌及脑胶质瘤等多种恶性肿瘤中被广泛报道,且多数研究提示其高表达与肿瘤侵袭性增强、转移风险增高和临床预后较差相关。这些证据共同确立了MET作为跨瘤种的重要预后生物标志物的地位。
鉴于MET表达状态对临床决策具有明确的指导意义,建立一种可靠、高效的检测方法以准确评估肿瘤组织中MET蛋白表达水平显得至关重要。
PART 04
MET IHC 检测
为了实现精准检测,使用循证医学证据充足的IHC检测平台、MET抗体和二抗显色体系进行MET过表达评估尤为重要。临床试验证据显示Ventana平台MET(SP44)IHC检测对指导EGFR-TKI耐药后伴MET过表达的晚期NSCLC患者的分层和治疗决策制定具有重要临床意义。

图5 NSCLC MET染色示意图(来自精翰生物IHC实验室)
PART 05
MET IHC检测的判读标准
目前临床研究的判读标准结合了相关抗体在肿瘤细胞中的表达强度和百分比。SAVANNAH[6]、TATTON[7] 、INSIGHT[8]等研究均采用Clinical Score标准[15],结合染色强度和阳性肿瘤细胞比例进行MET IHC评分(表1、表2)。除了使用Clinical Score标准外,还有研究者采用H-score评分系统来判断MET的表达情况[16-17],在一项评估Teliso‑V联合厄洛替尼治疗MET过表达晚期NSCLC患者疗效的研究中,研究者定义H‑score≥150为MET过表达阳性,H‑score≥225为高水平MET过表达[18-19]。两种评分标准均有助于深入了解MET过表达与肺癌患者治疗疗效之间的关系,为肺癌精准治疗提供依据。
表1 染色强度评估标准
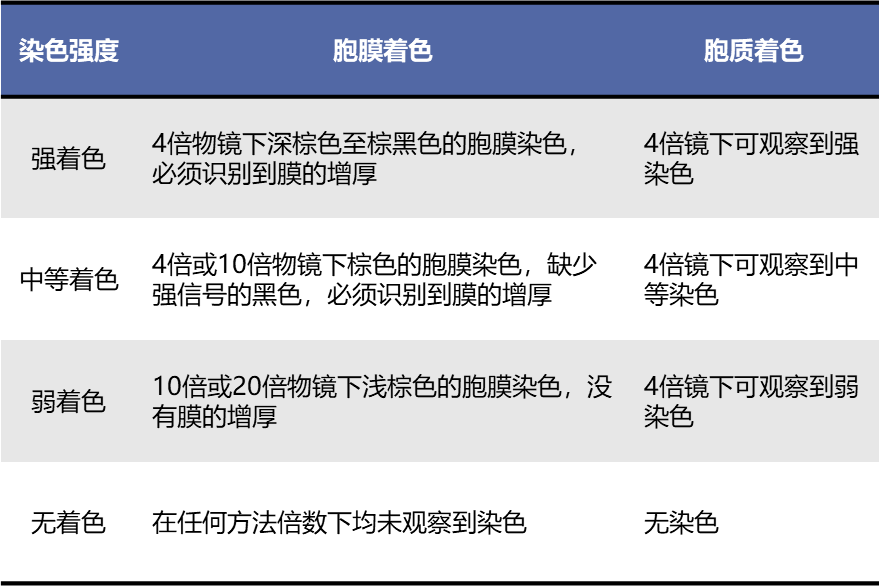
备注:染色强度不再使用0~3+表示,以便于与评分0~3+进行区分
表2 MET免疫组织化学评分标准

PART 06
MET靶向治疗进展与未来展望
2025年,中国NMPA相继批准赛沃替尼联合奥希替尼用于克服EGFR-TKI治疗后MET扩增耐药,以及伯瑞替尼单药治疗MET扩增晚期非小细胞肺癌(NSCLC),标志着应对这一关键耐药机制进入了精准靶向时代。与此同时,创新药物技术蓬勃发展:艾伯维的c-MET ADC药物Emrelis获加速批准,用于c-MET高表达(IHC ≥50%肿瘤细胞3+染色)的晚期非鳞NSCLC。
未来,MET IHC检测的标准化与规范化将是推动精准治疗的关键。通过统一检测与判读标准,不仅能为药物研发提供可靠依据,也有助于拓展获益人群。随着多学科诊疗模式的推广,基于IHC的MET蛋白检测将在肿瘤精准治疗中发挥越来越重要的作用。
PART 07
熙宁|精翰组织病理检测服务
熙宁生物|精翰生物的组织病理平台,在生物医药研发与临床应用的关键环节中,发挥着至关重要的作用。无论是在临床试验阶段,为药物疗效评估提供关键依据;还是在伴随诊断试剂盒前期开发,助力精准医疗的前沿探索;亦或是在动物病理研究,为基础医学提供扎实的数据支撑,熙宁生物的生物病理平台都能凭借其专业能力,提供全方位、高质量的病理支持服务。
在技术手段上,平台具备强大的技术实力,涵盖H&E染色、免疫组化(单染、双染)、mIHC、FISH、特殊染色等多种先进技术服务,能够充分满足各类复杂的病理检测需求。平台配备了BenchMark Ultra、Dako Autostainer Link 48、Leica Bond III等国际公认的全自动免疫组化染色机,这些设备为精准的检测结果提供了硬件保障。同时,平台严格遵从 CAP和GCP体系要求,秉持 “合规、精准、伴随诊断” 的先进理念,在技术开发上成果斐然。
平台已成功完成超200种靶标的免疫组化方法开发,其中包括PD-L1、Claudin18.2、HER2、HER3、TROP-2、dMMR、TIM-3、MSLN、B7H3 、c-MET等备受关注的关键靶标,且多种方法已获得NordiQC、CAP、CCPI等国内外权威机构的高度认可。凭借卓越的服务品质和专业能力,熙宁生物|精翰生物病理平台已与100多家客户建立了长期稳定的合作关系,深度参与了超过300个涵盖临床前、临床1-3期的各类病理检测项目,在行业内树立了良好的口碑和卓越的品牌形象。
若您有相关需求,欢迎拨打021-50833588转532与我们联系~


参考文献:
[1] Nakamura T, et al. Partial purification and characterization of hepatocyte growth factor from serum of hepatectomized rats. Biochem Biophys Res Comn. 1984;122:1450-1459.
[2] Comoglio P, Giordano S and Trusolino L. Drug development of MET inhibitors: targeting oncogene addiction and expedience. Nat Rev Drug Discov. 2008;7(6):504-516.
[3] Wang Q, Yang S, Wang K, Sun SY. MET inhibitors for targeted therapy of EGFR TKI-resistant lung cancer. J Hematol Oncol. 2019 Jun 21;12(1):63.
[4] Recondo G, Che J, Jänne PA, Awad MM. Targeting MET Dysregulation in Cancer. Cancer Discov. 2020 Jul;10(7):922-934.
[5] 中华医学会病理学分会.中华病理学杂志. 2022; 51(11) 1094-1103.
[6] Hartmaler RJ, et al. Osimertinib+savolitinib to overcome acquired MET-mediated resistance in epidermal growth factor receptor-mutated,MET-amplifed non-small cell lung cancer: TATTON[J].Cancer Discov,2023,13(1):98-113.
[7] Ahn MJ, et al. MET biomarker-based preliminary efficacy analysis in SAVANNAH: savolitinib+osimertinib in EGFRm NSCLC post-osimertinib[J]. WCLC,2022,Abs.08.02-140.
[8] Wu YL, Cheng Y, Zhou J, et al. Tepotinib plus gefitinib in patients with EGFR-mutant non-small-cell lung cancer with MET overexpression or MET amplification and acquired resistance to previous EGFR inhibitor (INSIGHT study):an open-label,phase 1b/2,multicentre,randomised trial[J]. Lancet Respir Med,2020,8(11):1132-1143.
[9] Wu YL, Zhang L,Kim DW, et al. Phase Ib/II study of capmatinib(INC280) plus gefitinib after failure of epidermal growth factor receptor(EGFR) in hibitor therapy in patients with EGFR-mutated,MET factor-dysregulated non-small-cell lung cancer[J]. J Clin Oncol, 2018,36(31):3101-3109.
[10] 李雄峰,陈振文,郗彦风,等.肺腺癌中C-met表达与表皮生长因子受体-酪氨酸激酶抑制剂耐药的相关性町1.肿瘤研究与临床,2018,30(1):1-6.
[11] Lv H, et al. Soluble c-Met is a reliable and sensitive marker to detect c-Met expression level in lung cancer. Biomed Res Int. 2015;2015:626578.
[12] Wang N, et al. MET overexpression in EGFR L858R mutant treatment-naïve advanced lung adenocarcinoma correlated with poor prognosis: a real-world retrospective study. J Cancer Res Clin Oncol. 2023 Jul;149(7):3219-3228.
[13] Zhan S, et al. Landscape of C-MET overexpression in non-small cell lung cancer: a large-scale study of clinicomolecular features and prognosis based on Chinese data. Ther Adv Med Oncol. 2024 Sep 25;16:17588359241279715.
[14] Metzger ML, et al. MET in gastric cancer--discarding a 10% cutoff rule. Histopathology. 2016 Jan;68(2):241-53. doi: 10.1111/his.12745. Epub 2015 Jul 14. PMID: 26033401; PMCID: PMC4744765.
[15] 非小细胞肺癌MET免疫组织化学检测和判读标准中国专家共识(2023版)
[16] Camidge DR, et al. Phase I Study of 2- or 3-Week Dosing of Telisotuzumab Vedotin, an Antibody-Drug Conjugate Targeting c-Met, Monotherapy in Patients with Advanced Non-Small Cell Lung Carcinoma. Clin Cancer Res. 2021 Nov 1;27(21):5781-5792.
[17] Wang J, et al. ABBV-399, a c-Met Antibody-Drug Conjugate that Targets Both MET-Amplified and c-Met-Overexpressing Tumors, Irrespective of MET Pathway Dependence. Clin Cancer Res. 2017 Feb 15;23(4):992-1000.
[18] Camidge DR, Morgensztern D, Heist RS, et al. Phase I Study of 2-or 3-week dosing of telisotuzumab vedotin, an antibody-drug conjugate targeting c-Met, monotherapy in patients with advanced non-small cell lung carcinoma [J].Clin Cancer Res,2021,27(21):5781-5792.
[19] Camidge DR, Barlesi F, Goldman JW, et al. Phase lb study of telisotuzumab vedotin in combination with erlotinib in patients with c-Met protein-expressing non-small-cell lung cancer[J].J Clin Oncol,2023,41(5):1105-1115.