



免疫系统对外来和自身抗原的区分不是绝对的,在某些情况下,机体免疫系统功能的异常,会导致机体攻击自身组织,这类疾病被称为“自身免疫性疾病(autoimmune diseases,AIDs)”。AIDs在人群中的发病率极高,约7~9% [1]。目前已确定的81种AIDs[2],根据组织受损的程度被分为:(1)器官特异性疾病,如I型糖尿病(T1DM)、多发性硬化症(MS)、炎症性肠病(IBD)和重症肌无力(MG)等;(2)全身性疾病,如系统性红斑狼疮(SLE)、类风湿性关节炎(RA)和Sjögren综合征(SS)等。
免疫系统攻击自身组织,主要由T和B淋巴细胞参与,这一过程被认为会促进疾病的进展。先前的研究表明,多种AIDs患者体内都存在TCR异常表达。此外,在一些AIDs中发现了TCR库的变化,这可能是因为外周免疫耐受遭到了破坏。正常情况下,TCR是随机重排的,CDR3长度的分布大致为高斯分布[3]。然而,在一些AIDs中,TCR和疾病特异性CDR3克隆型的分布存在偏倚,这可能与自身抗原暴露和表位扩增有关。因此,TCR库测序提供了研究免疫疾病的新策略,尤其是疾病特异性的主克隆可以作为生物标志物或免疫治疗的潜在靶标,并帮助医生监测患者对治疗干预的反应。目前TCR库的研究已在多种AIDs中进行,本文将以系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、I型糖尿病(T1DM)这三类AIDs为例,简单介绍TCR库在疾病中的作用。
PART 01
系统性红斑狼疮(SLE)
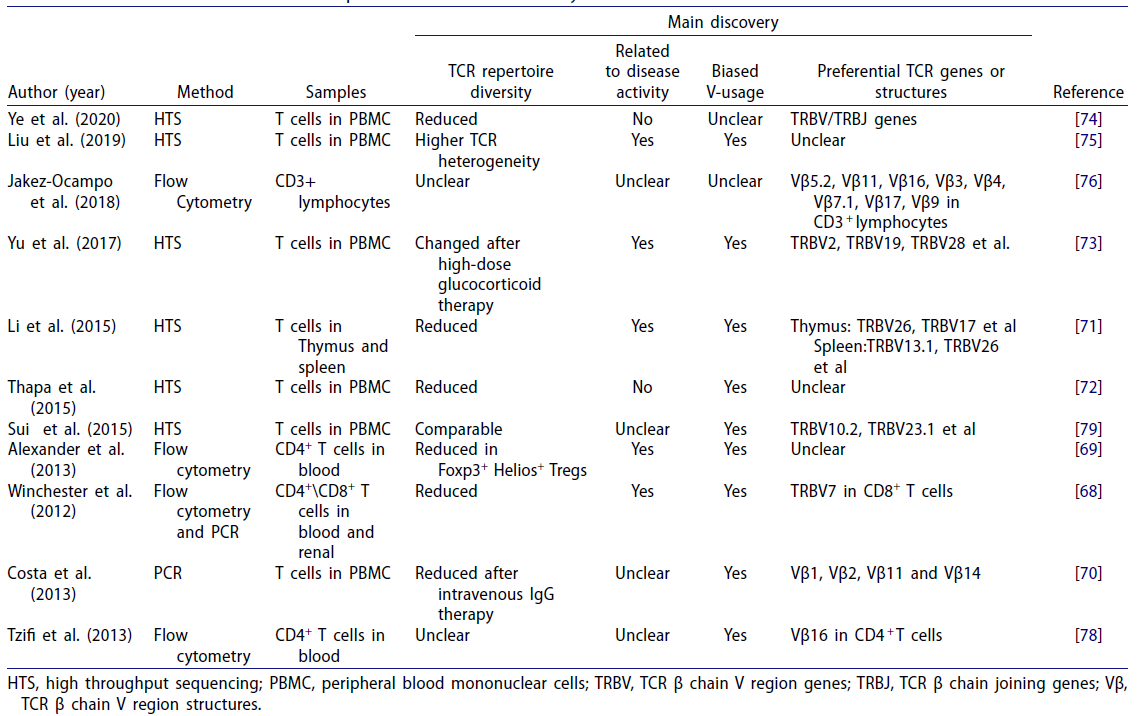
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统的慢性炎症性疾病,主要发生于年轻女性。常见表现可包括多关节痛和关节炎、雷诺综合征、面颊及其他部位皮疹、胸膜炎或心包炎、肾脏或中枢神经系统受累以及自身免疫性细胞减少。临床上对SLE患者的TCR库变化进行了广泛的研究(表1)[3]。
表1 关于系统性红斑狼疮TCR库的研究[3]
Thapa等在一项研究中利用NGS来评估11例SLE患者外周血中TCR库多样性的变化是否与疾病状态相关,或是否能预测其变化[4]。每个受试者有三个样本,分别在疾病的临床静止期和爆发期收集。同时选取12名年龄匹配的健康志愿者(HC)作为对照。结果如图1所示,与健康人相比,SLE患者(处于静止状态)的TCR库多样性减少了2.2倍(P<0.0002),tcr库分布更不均匀(gini系数,hc vs="" p="0.015),TCR库中扩增克隆的百分比有增加趋势(克隆大小">1.0%,HC vs SLE, P = 0.078)。但是,在大多数SLE患者中,未观察到总体的TCR库多样性与临床疾病活动之间有显著相关性(图2)。因此,在不知道SLE特异性克隆的情况下,监测SLE患者外周血中的TCR库可能无法准确预测疾病活动状态的变化。
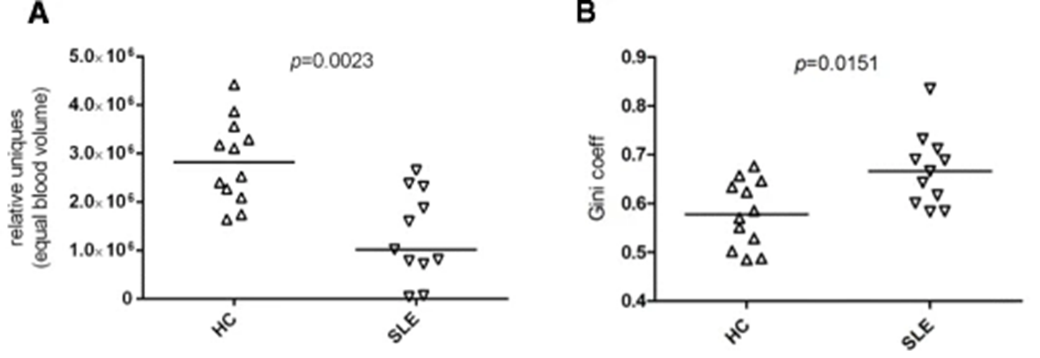
图1 健康对照(HC)和系统性红斑狼疮(SLE)患者TCR库分析[4]
注:A,通过测量每标准化血体积的克隆型数量得到的TCR库多样性,HC vs SLE(Mann-Whitney检验);B,克隆型分布的均匀性,使用Gini系数,HC vs SLE(Mann-Whitney检验)
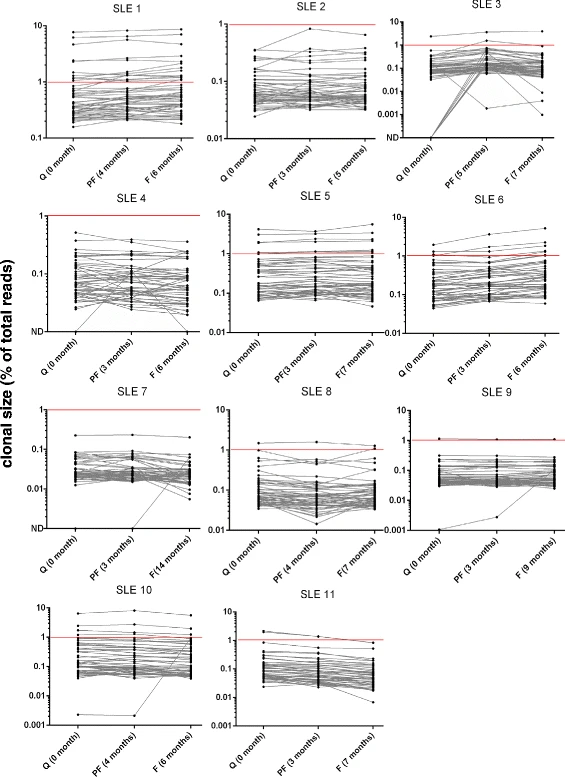
图2 SLE患者TCR库的纵向分析[4]
注:前50个无性系克隆型的频率及相对排名。SLE患者的三个采样时间点分别为静止(Q)、爆发前(PF)和爆发(F)。从第一个样本开始计算的时间(月)。水平红线以上的克隆(>1%)表示高度扩增克隆(HEC)
然而,另一些研究却得出截然不同的结果。例如,Luo等人[5]为了寻找特异性TCR α和β链的保守基序,并分析CDR3谱型与SLE疾病活动状态之间的关系,分析20例SLE患者的TCR α和β链CDR3的谱型,结果表明CDR3谱型随SLE疾病活动状态的变化而呈现动态变化趋势(图3)。
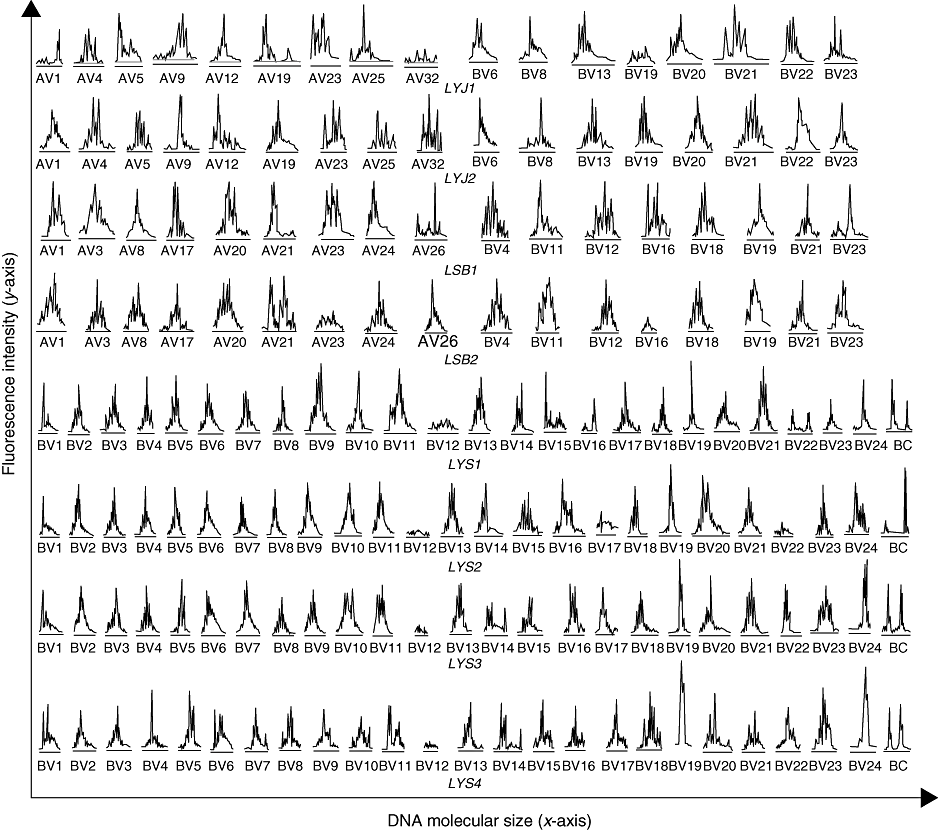
图3 局部分析SLE患者LYJ和LSB在治疗前后TCR AV和BV家族的使用变化,以及患者LYS在4个疾病阶段的所有BV家族特征
PART 02
类风湿性关节炎(RA)
类风湿关节炎(rheumatoid arthritis,RA)是一种主要累及关节的慢性系统性自身免疫性疾病,由细胞因子、趋化因子和金属蛋白酶介导。对称性外周关节炎(如腕关节和掌指关节)是类风湿关节炎的主要特征,受累关节结构进行性破坏,并常伴有全身症状。科学家们在探索RA患者的TCR库多样性方面做出了巨大的努力(表2)。
表2 关于类风湿性关节炎(RA)TCR库的研究[3]
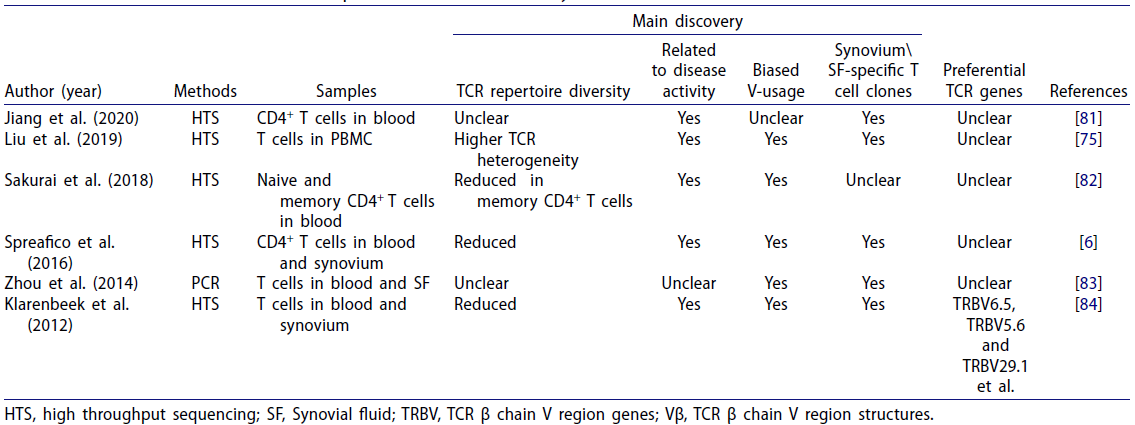
Jiang等人在一项研究[6]中将来自未经治疗的RA患者和健康志愿者的外周CD4+ T细胞分成7个亚群(naïve、效应、中枢记忆、效应记忆(EMT)、Th1、Th17和调节性T细胞),然后通过NGS分析TCR β链的谱型,结果显示(图4和图5),相比于健康志愿者,在RA患者的EMT和Th17细胞中发现了更少的TCR库多样性和T细胞的克隆扩增,它们具有高度相似的TCR谱型。另外,此研究还发现TCR库多样性和Th17细胞的丰度与RA疾病活动显著相关。
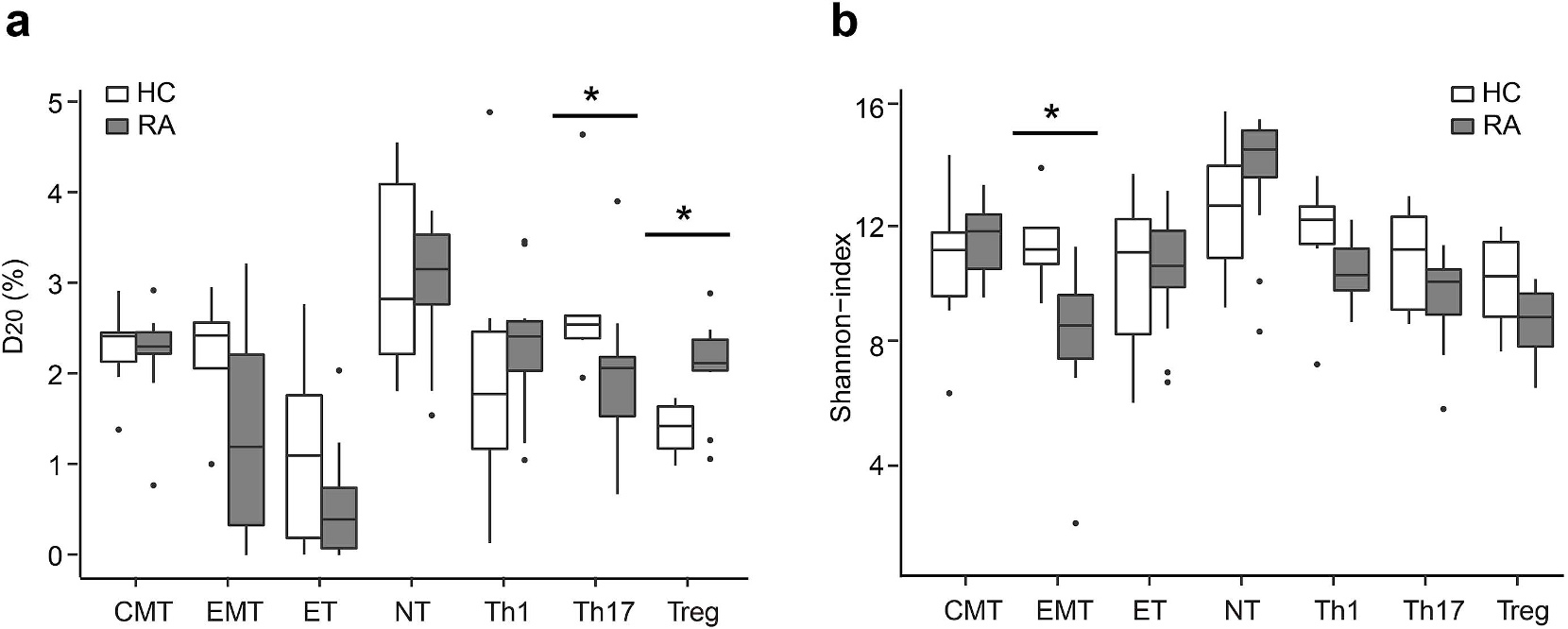
图4 RA患者的Th17和EMT细胞的多样性低于健康对照(HC)[6],计算D20指数(a)和Shannon指数(b)
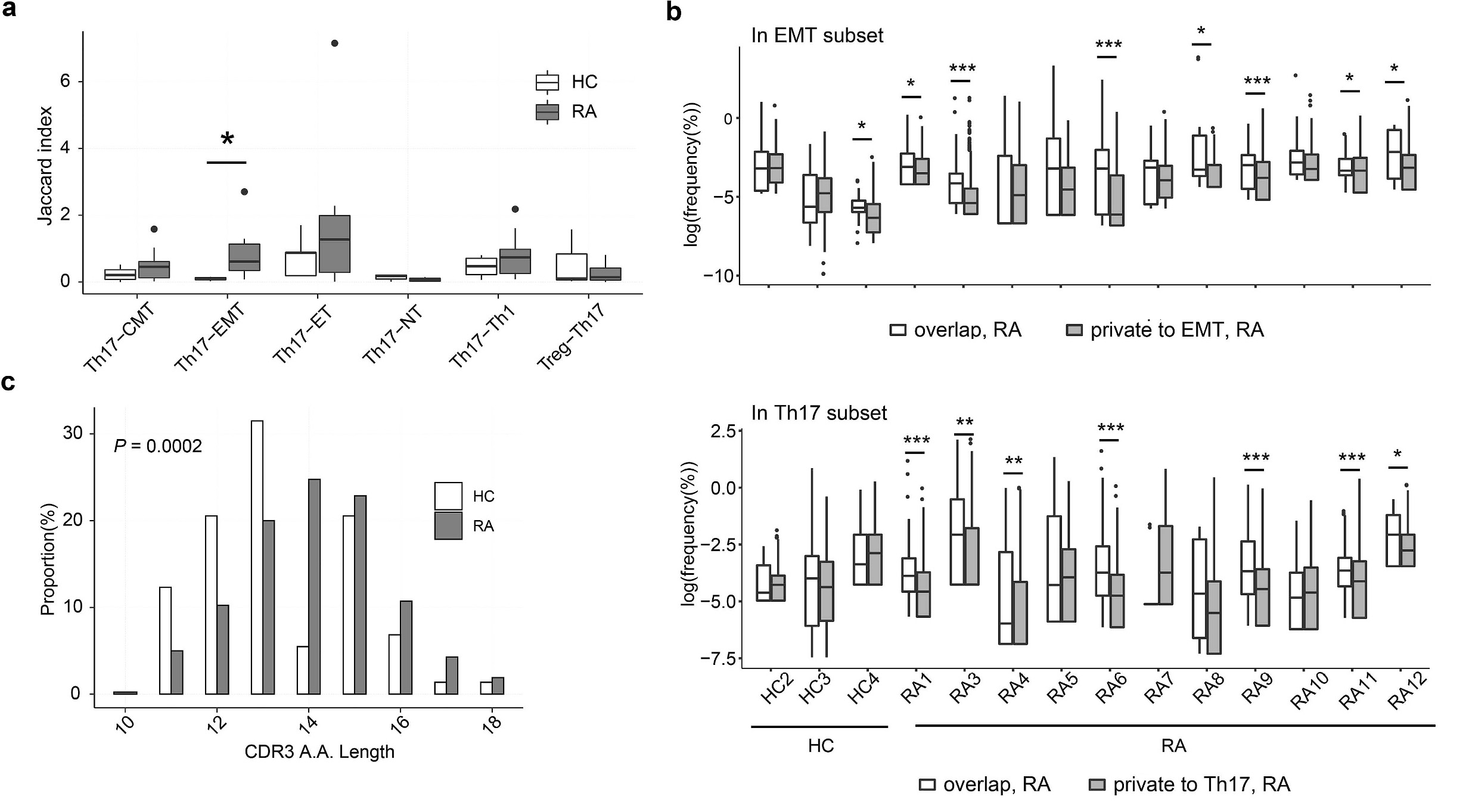
图5 TCRB CDR3s在RA患者的Th17和EMT细胞中高度共享[6]
注:(a)计算Th17和其他亚群之间的Jaccard指数,与健康对照(hc)相比,RA患者Th17和EMT细胞的CDR3s表现出更多的相似性;(b)在RA中,EMT(上)和Th17(下)克隆型的重叠频率高于私有克隆型;(c)RA和HC重叠克隆型长度分布,RA重叠克隆型明显长于HC重叠克隆型
此外,多项研究表明,RA患者的循环T细胞表现为TCR库多样性降低,其特异性扩增的T细胞克隆型与RA的治疗耐药性和疾病活动状态相关[3]。
PART 03
I型糖尿病(T1DM)
I型糖尿病(type 1 diabetes mellitus,T1DM)主要是由于遗传易感人群在环境因素作用下触发自身免疫反应破坏胰岛β细胞,使胰岛素分泌不足。 与SLE和RA类似,T1DM患者也发现TCR库多样性降低(表3)。
表3 关于I型糖尿病TCR库的研究[3]
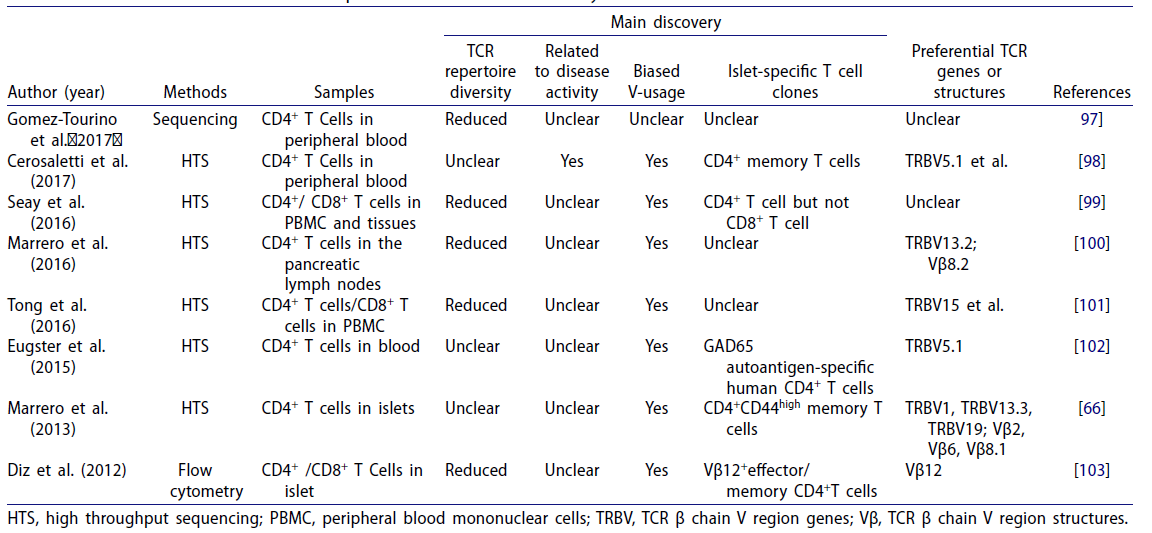
例如,Tong等人[7]为了系统地研究潜在的自身反应性TCRs,使用NGS对9名T1DM患者、4名T2DM患者和6名健康对照组的T细胞进行测序。结果显示,与T2D患者和健康对照组相比,T1D患者T细胞库的多样性显著降低(图6)。此外,T1D患者的T细胞克隆高度扩增明显高于T2D患者和健康对照组。结果表明TCR库多样性分析可能成为研究糖尿病的有价值工具。
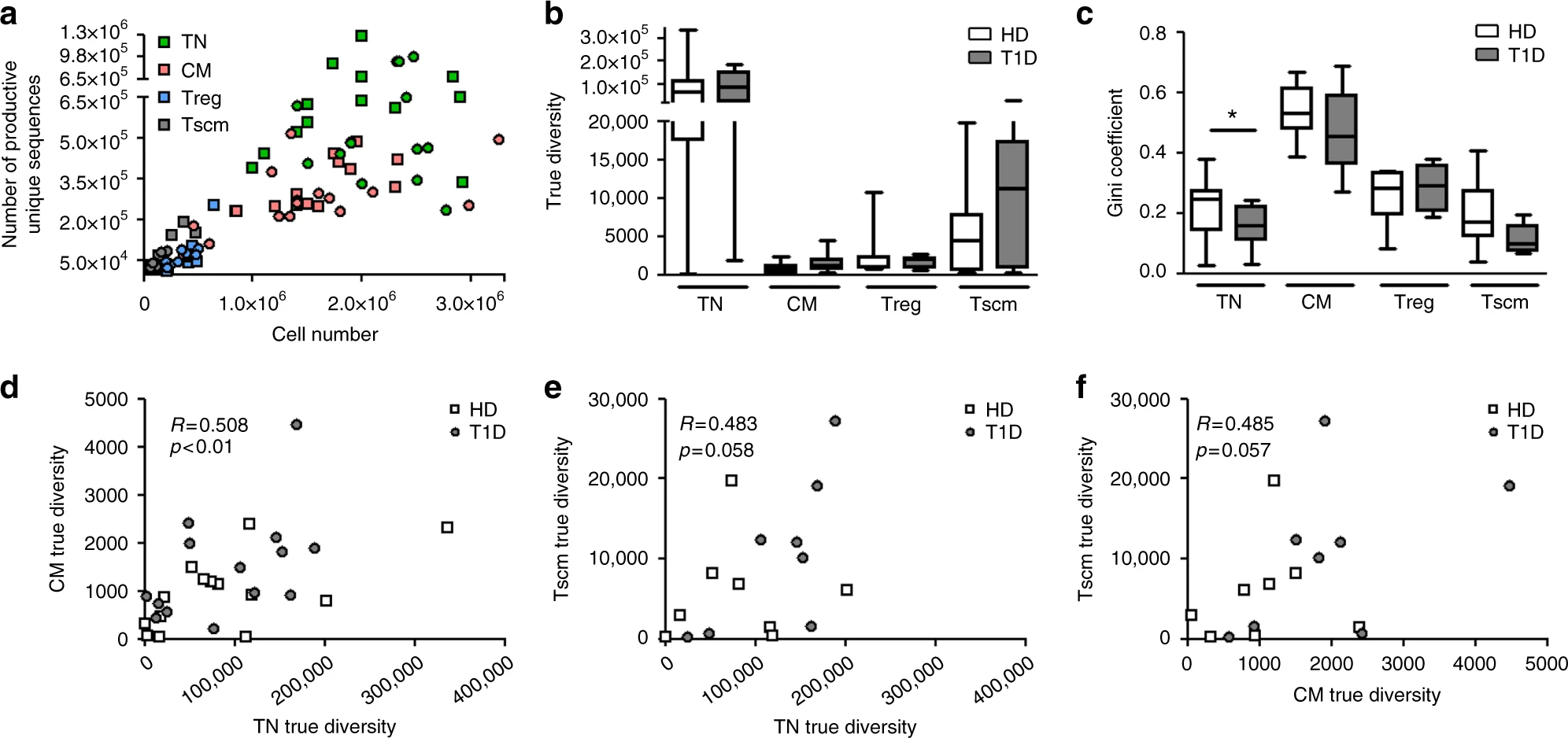
图6 CD4+ T细胞TCRB库的多样性及克隆指数[7]
注:(a)产生的唯一序列(唯一克隆型)的数量与细胞数量相关(Spearman’s R = 0.85,p < 0.0001)。对测序数据进行归一化,计算真多样性指数(b)和Gini系数(c)。来自患者的TN细胞克隆性低于来自健康供体的TN细胞(Mann-Whitney U检验)。物种被定义为一个独特的核苷酸序列。(d-f)真多样性指数在TN、CM和Tscm细胞亚群之间呈正相关,与CM和Tscm从TN传代一致(Pearson相关性)。TN,真幼稚细胞;CM,中央记忆细胞;Treg,调节性T细胞;Tscm,干细胞样记忆T细胞
在另外一项研究[8]中,Gomez-Tourino等人通过分析来自T1DM患者和健康志愿者的循环初始、中枢记忆、调节性和干细胞样记忆CD4+ T细胞亚群的>2×108个TCRB序列,发现在所有细胞亚群中,患者的TCRB的CDR3序列长度更短,在非生产性TCRB序列中也观察到高频率的短CDR3序列(图7)。此外,与抗病毒T细胞和健康志愿者相比,由自身抗原特异性CD4+ T细胞表达的TCRB CDR3克隆型更短,表明短CDR3序列增加了自我识别的能力,从而增加了自身免疫性疾病的风险。
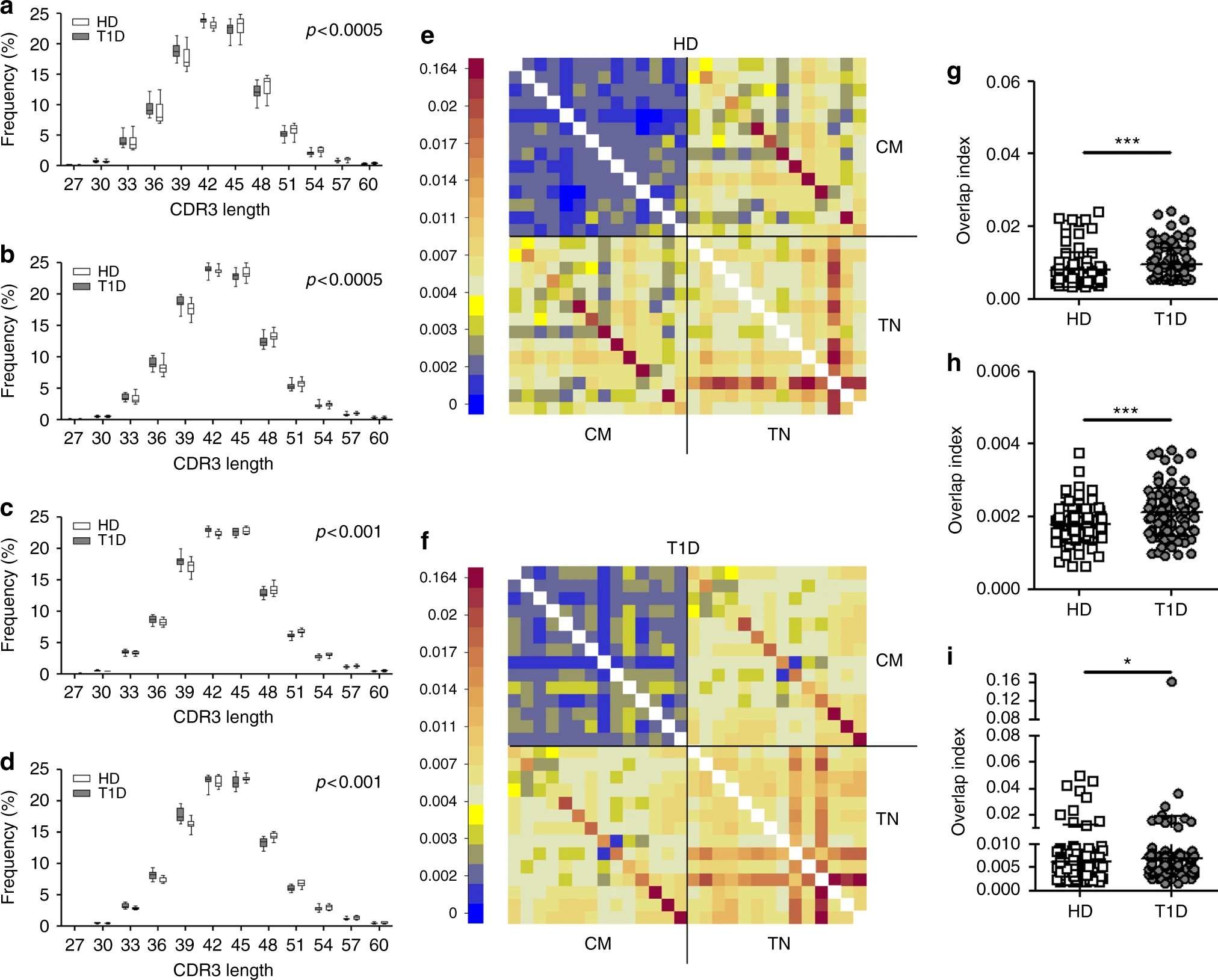
图7 在T1D患者中TCRB CDR3s较短以及具有较大的相似性[8]
注:来自(a)TN、(b)CM、(c)Treg和(d)Tscm细胞的TCRB CDR3生产独特序列的核苷酸长度在患者中呈现偏倚的长度分布。e, f计算了14名健康供体(e)和14名T1D患者(f)的TN和CM TCRB的重叠指数。(g)TN/TN、(h)CM/CM和(i)TN/CM 细胞亚型的重叠指数(Mann-Whitney U检验)。*p < 0.05,***p < 0.001。线代表平均值±SD
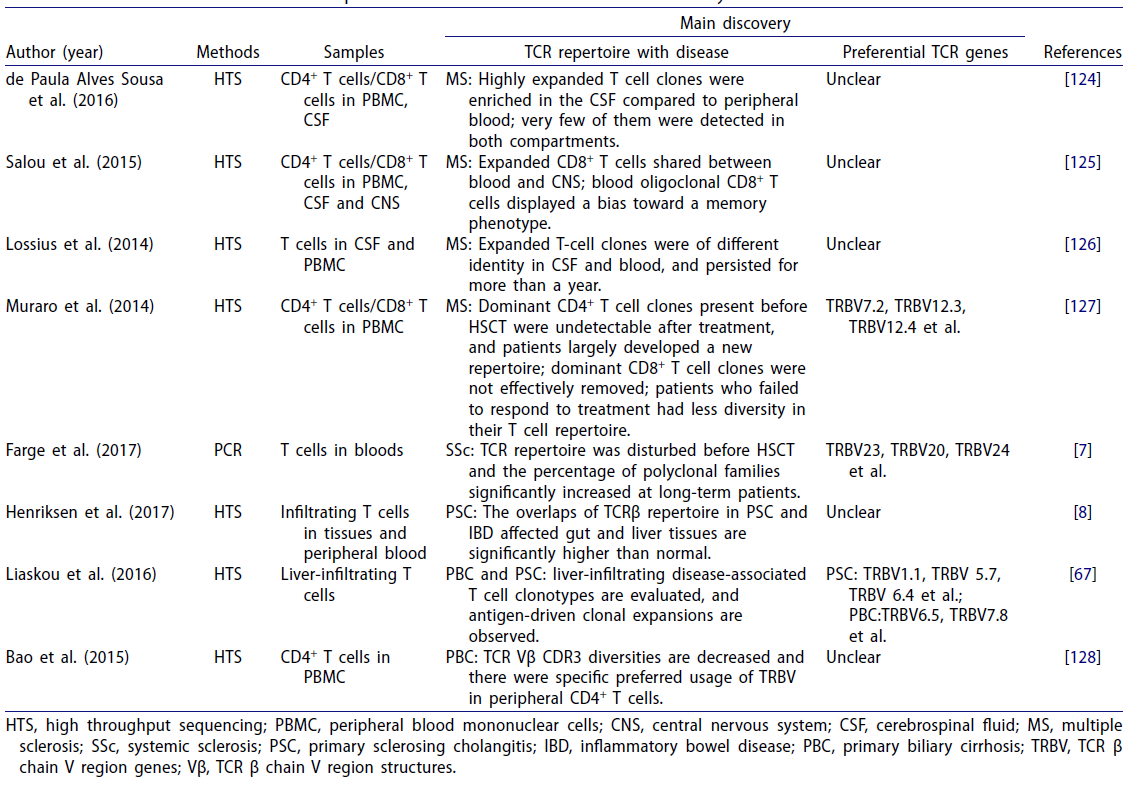
除上述提到的几种AIDs外,研究人员还探索了许多其他AIDs患者的TCR库,如MS、IBD、SSc、PBC等。相关研究总结如表4 [3]。
表4 关于其他自身免疫性疾病TCR库的研究[3]
PART 04
小结
在过去的几十年里,人们对T淋巴细胞及其亚群在AIDs的发生和发展中的复杂而重要的作用有了更多的了解,但仍有许多未解之谜,比如TCR库在AIDS中的细胞和分子机制。了解AIDs患者体内的疾病特异性主克隆型有助于建立一套可靠的生物标志物用于诊断、预测疾病状态以及发展个性化的免疫治疗。
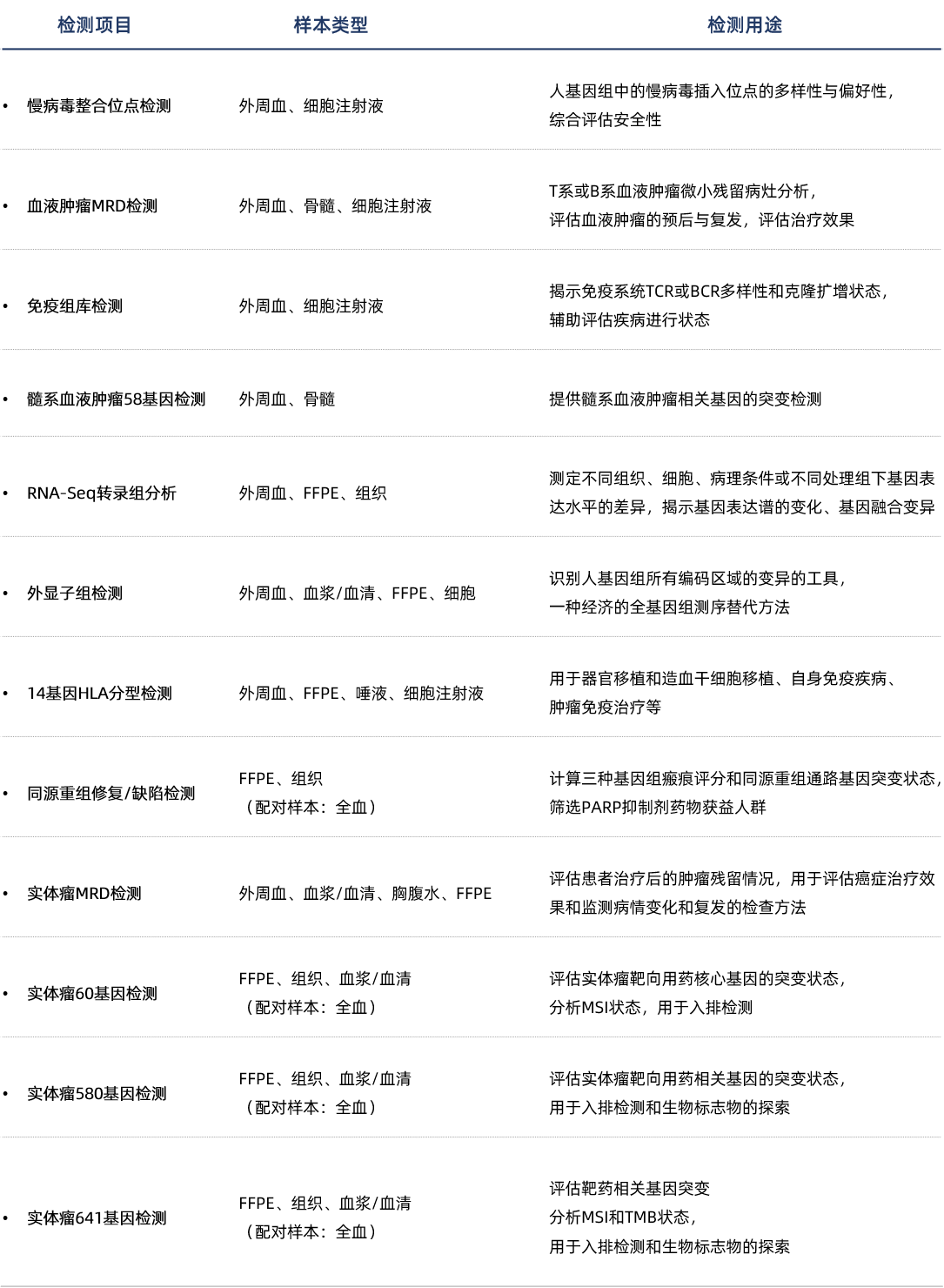
熙宁|精翰NGS实验室应用基于多重PCR建库的免疫组库检测方法特异性地扩增TCR/Ig受体链编码基因(TRB、TRD、TRG,以及IgH、IgL、IgK),检测T/B细胞受体基因的克隆性重排,通过专业的生物信息学流程分析识别受体可变区,统计样本的克隆多样性及V/J片段的使用频率,从而揭示个体的免疫表达谱。本检测方法已经经过了完善的性能验证,可以供申办方直接使用。
熙宁|精翰NGS实验室依据CAP质量的要求,建立了完善的质量体系。实验室拥有NextSeq CN500测序仪,支持本地测序,且多次满分通过CAP的能力验证。按照质量体系的要求,实验室建立了丰富的检测方法,全面支撑药物的安全性评估、治疗效果评估、入组筛查和生物标志物的探索等,在药物研发的各个环节发挥重要作用:
熙宁|精翰NGS平台可提供的检测服务
➢
以慢病毒为载体的CAR-T细胞治疗中,识别有致瘤性的或者其他潜在危险的整合位点,评估整合事件的多样性和偏好性,辅助评估药物潜在的安全性风险;
➢
通过对肿瘤微小残留病灶(MRD)的检测,评估药物治疗效果并提示预后,提前提示复发风险并指导后续干预;
➢
通过基因组和转录组测序,帮助申办方识别与疾病关联的基因突变、融合突变和拷贝数变异等,识别受试者药物靶点变异情况,以及与药物转运、代谢和相关信号通路的基因变化,从而指导患者入排,发现药物研发的潜在靶点和生物标志物,并指导耐药机制研究和新的治疗策略开发;
➢
评估候选药物对基因表达的影响,筛选出对特定靶标有显著作用的化合物,同时通过分析药物处理前后基因表达变化,优化药物的剂量、作用机制和潜在副作用。
欢迎您后台留言咨询。
参考文献:
[1] Theofilopoulos AN, Kono DH, Baccala R. The multiple pathways to autoimmunity. Nat Immunol. 2017 Jun 20;18(7):716-724. doi: 10.1038/ni.3731. PMID: 28632714; PMCID: PMC5791156.
[2] FANG Xin-yu, LENG Rui-xue, FAN Yin-guang, ZHANG Qin, PAN Hai-feng, YE Dong-qing. Research advances in the epidemiology of autoimmune diseases[J]. CHINESE JOURNAL OF DISEASE CONTROL & PREVENTION, 2021, 25(8): 869-873. doi: 10.16462/j.cnki.zhjbkz.2021.08.001
[3] Song R, Jia X, Zhao J, Du P, Zhang JA. T cell receptor revision and immune repertoire changes in autoimmune diseases. Int Rev Immunol. 2022;41(5):517-533. doi: 10.1080/08830185.2021.1929954. Epub 2021 Jul 9. PMID: 34243694.
[4] Thapa DR, Tonikian R, Sun C, Liu M, Dearth A, Petri M, Pepin F, Emerson RO, Ranger A. Longitudinal analysis of peripheral blood T cell receptor diversity in patients with systemic lupus erythematosus by next-generation sequencing. Arthritis Res Ther. 2015 May 23;17(1):132. doi: 10.1186/s13075-015-0655-9. PMID: 26001779; PMCID: PMC4458014.
[5] Luo W, Ma L, Wen Q, Wang N, Zhou MQ, Wang XN. Analysis of the interindividual conservation of T cell receptor alpha- and beta-chain variable regions gene in the peripheral blood of patients with systemic lupus erythematosus. Clin Exp Immunol. 2008 Dec;154(3):316-24. doi: 10.1111/j.1365-2249.2008.03770.x. Epub 2008 Sep 22. PMID: 18811695; PMCID: PMC2633227.
[6] Jiang X, Wang S, Zhou C, Wu J, Jiao Y, Lin L, Lu X, Yang B, Zhang W, Xiao X, Li Y, Wu X, Wang X, Chen H, Zhao L, Fei Y, Yang H, Zhang W, Zhang F, Chen H, Zhang J, Li B, Yang H, Wang J, Liu X, Zhang X. Comprehensive TCR repertoire analysis of CD4+ T-cell subsets in rheumatoid arthritis. J Autoimmun. 2020 May;109:102432. doi: 10.1016/j.jaut.2020.102432. Epub 2020 Feb 27. PMID: 32115259.
[7] Tong Y, Li Z, Zhang H, Xia L, Zhang M, Xu Y, Wang Z, Deem MW, Sun X, He J. T Cell Repertoire Diversity Is Decreased in Type 1 Diabetes Patients. Genomics Proteomics Bioinformatics. 2016 Dec;14(6):338-348. doi: 10.1016/j.gpb.2016.10.003. Epub 2016 Dec 24. PMID: 28024918; PMCID: PMC5200939.
[8] Gomez-Tourino I, Kamra Y, Baptista R, Lorenc A, Peakman M. T cell receptor β-chains display abnormal shortening and repertoire sharing in type 1 diabetes. Nat Commun. 2017 Nov 27;8(1):1792. doi: 10.1038/s41467-017-01925-2. PMID: 29176645; PMCID: PMC5702608.