



流式细胞术(flow cytometry,FCM)是利用流式细胞仪对于处在快速直线流动状态中的细胞或生物颗粒同时进行多参数、快速定量分析和分选的高新技术,在临床样品分析中,可以支持包括免疫分型/淋巴细胞亚群分析、磷酸化/甲基化/泛素化蛋白、受体占位、胞内因子、微小残留病监测等多种检测分析。在淋巴细胞亚群分析中,最普遍常用的指标包括对CD3+T淋巴细胞,CD3+CD4+辅助/诱导T淋巴细胞,CD3+CD8+抑制/杀伤T淋巴细胞,CD3-CD19+B淋巴细胞,CD3-(CD16+CD56)+NK淋巴细胞,以及CD3+CD4+CD25+CD127-/low调节性T细胞(Treg)。此外,单核细胞中的CD14+阳性细胞群也会在部分项目中与淋巴细胞亚群相结合,因此共同分析,即TBMNK。
近期,中国医药质量管理协会医学检验质量管理专业委员会发布了一篇《淋巴细胞亚群检测在血液肿瘤中应用的专家共识》(以下简称《共识》),我们归纳总结了其中的关键要点,结合熙宁生物|精翰生物在淋巴细胞亚群检测众多项目累积的经验,做一个简要梳理,抛砖引玉,欢迎交流讨论。
在淋巴细胞亚群检测中,TBNK推荐的单抗为CD45、CD3、CD4、CD8、CD19、CD16、CD56,Treg检测的单抗为CD4、CD25、CD3、CD127。CD3+T细胞标记为CD3+,CD4+T细胞标记为CD3+CD4+,CD8+T细胞标记为 CD3+CD8+,B细胞标记为CD3-CD19+,NK细胞标记为CD3-(CD16+CD56)+,Treg细胞的标记为CD3+CD4+CD25+FoxP3+或CD3+CD4+CD25+CD127-/low。T细胞表面CD127的低表达与T细胞质内FoxP3的高表达具有良好的相关性,且以CD127为标志进行检测的方法明显优于以细胞质内FoxP3为标志的检测方法[1-3],因此也可以使用CD127替代FoxP3进行Treg细胞的分析。
使用CD25+FoxP3+和CD25+CD127-/low两种方式标记Treg,熙宁生物|精翰生物均具有丰富的项目经验。基于熙宁生物|精翰生物的项目经验而言,使用CD25+CD127-/low标记Treg的方法可在室温/2-8℃,两种储存条件下稳定储存12天(days,下文简称“D”);使用CD25+FoxP3+标记Treg的方法可在室温稳定储存4D,在2-8℃稳定储存5D。综上,使用CD127替代FoxP3标记Treg在方法的稳定性方面具有极大的提升,这与《共识》中的结论也是统一的。熙宁生物|精翰生物使用CD127-/low CD25+标记Treg的部分稳定性数据展示如下:
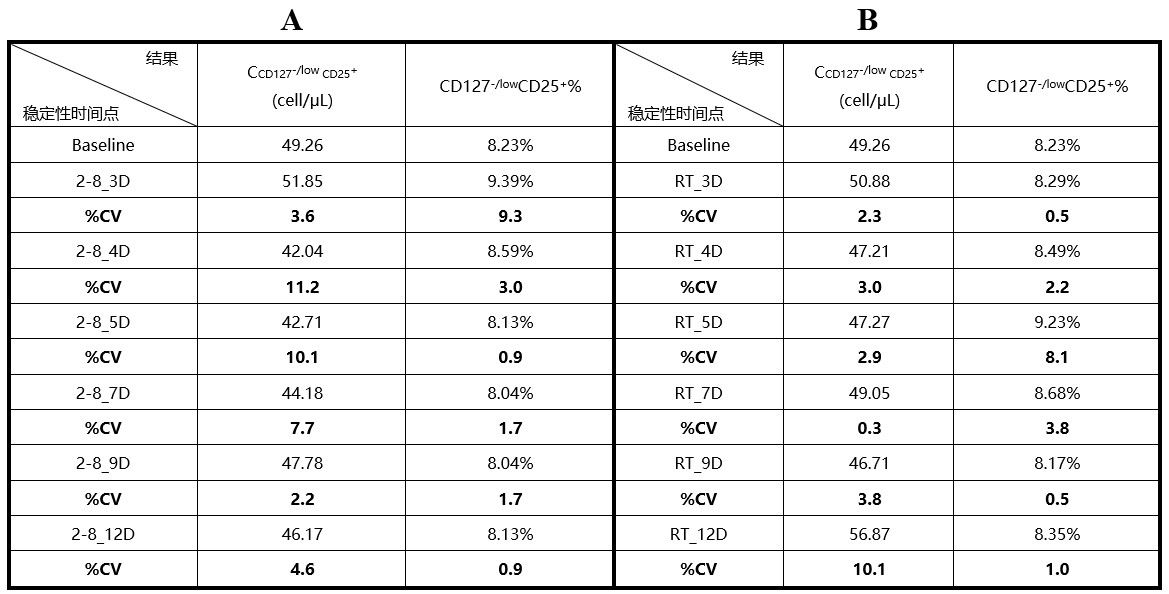
表1 使用CD127-/low CD25+标记Treg的稳定性数据
注:该方法已经过熙宁生物|精翰生物内部全验证,可直接支持样品分析。“CD127-/lowCD25+%” 为CD127-/lowCD25+占父群的比例,即Treg占CD4+T细胞亚群的比例。A,室温储存稳定性数据,与基线相比%CV范围为:0.9%-11.2%。B,2-8℃储存稳定性数据,与基线相比%CV范围为:0.3%-10.1%。
淋巴细胞亚群检测可以通过单平台法或双平台法[4]进行,取样时,首选乙二胺四乙酸二钾(EDTA-K2)抗凝真空管采集外周静脉血标本,并在24h内进行检测。送检时间超过30h应该采用肝素钠或枸橼酸钠抗凝,可在室温下稳定保存至48h,若送检时间超过48h,应该使用流式细胞检测专用的样本保存液或样本保存管,可稳定保存至14D。熙宁生物|精翰生物已有经过全验证的TBMNK检测方法,使用特殊采血管进行样品采集,可直接用于支持临床样本中CD3+T淋巴细胞,CD3+CD4+辅助/诱导T淋巴细胞,CD3+CD8+抑制/杀伤T淋巴细胞,CD3-CD19+B淋巴细胞,CD3-CD16+/CD56+NK淋巴细胞占淋巴细胞的比例,和CD14+单核细胞占单核细胞的比例,及各个细胞亚群在外周血中浓度的检测。已验证可在室温/2-8℃,两种储存条件下稳定储存14D,部分稳定性数据展示如下:

表2 人全血中TBMNK稳定性数据
注:使用特殊采血管采集的人全血,室温储存14天后,与基线相比%CV范围为0.3%-13.8%。
在健康成年人外周血中,T、B、NK及Treg细胞在今年的多项研究中均有发布,针对我国不同地区、年龄等健康人群均提供了相应的参考区间,见下表:
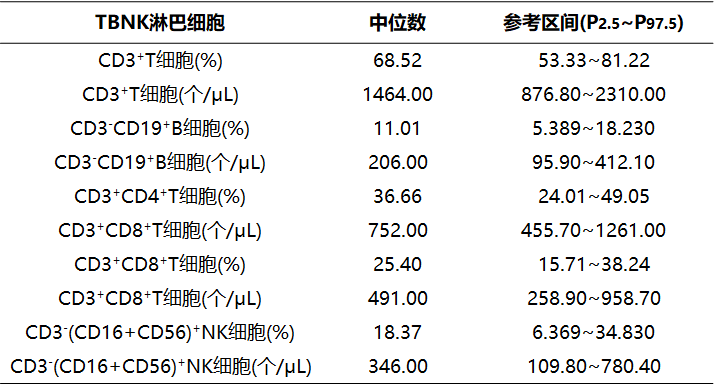
表3 健康成年人外周血TBNK淋巴细胞参考区间
注:我国九省(湖北、河南、广东、吉林、山东、山西、江苏、浙江、四川)20~60岁健康成人TBNK淋巴细胞参考区间的研究结果,供参考。

表4 健康成年人外周血Treg细胞参考区间
血液肿瘤作为造血干细胞异常的恶性肿瘤,疾病的多种因素会影响免疫细胞的产生、增殖及分化,使外周血的淋巴细胞数量与功能产生异常,导致免疫功能失调,因此对血液肿瘤患者进行规范的淋巴细胞亚群检测十分必要。淋巴细胞亚群检测在血液肿瘤患者中的应用包括以下几个方面:
1.淋巴细胞亚群分析可以支持部分血液肿瘤的筛查(如急性淋巴细胞白血病(ALL)、慢性淋巴细胞增殖性疾病(CLPD)等)
当出现以下情况:
① B或NK淋巴细胞显著增高;
② CD3+CD4+CD8+T淋巴细胞或CD3+CD4-CD8-T淋巴细胞明显增高;
③ CD4/CD8比值大于10:1或小于1:10;
④ CD3+%+CD19+% +(CD16+CD56)+%明显大于或小于(100 ± 5)%、CD4+%+CD8+%明显大于或小于CD3+%(变化范围为5%~10%);
在排除标本、仪器、设门、试剂及反应性改变等因素后,需要考虑标本中存在异常淋巴细胞,并结合临床进行血液肿瘤的筛查。血液肿瘤常见的淋巴细胞亚群改变见下图:
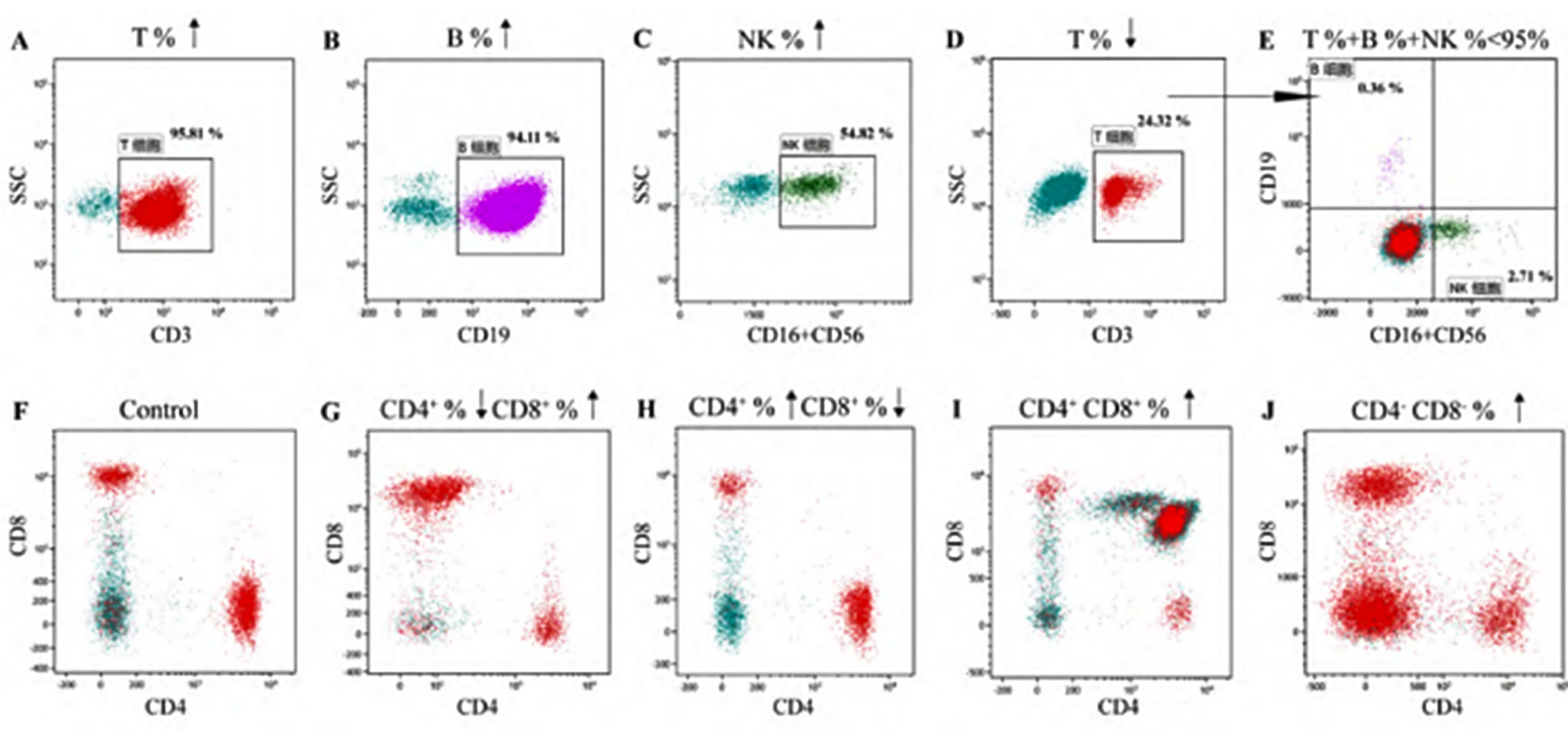
注:A表示T淋巴细胞群比例增高;B表示B淋巴细胞群比例增高;C表示NK细胞群比例增高;D、E表示同一患者T、B、NK三群淋巴细胞比例之和小于95%,存在不表达CD3、CD19、CD16和CD56的淋巴细胞;F表示CD4+T、CD8+T淋巴细胞群比例大致正常;G表示CD4+T淋巴细胞群比例降低,CD8+T淋巴细胞群比例增高;H表示CD4+T淋巴细胞群比例增高,CD8+T淋巴细胞群比例降低:I表示中CD4+CD8+T淋巴细胞群比例增高:J表示 CD4-CD8-T淋巴细胞群比例增高。
血液肿瘤淋巴细胞亚群筛查与随访路径见下图:
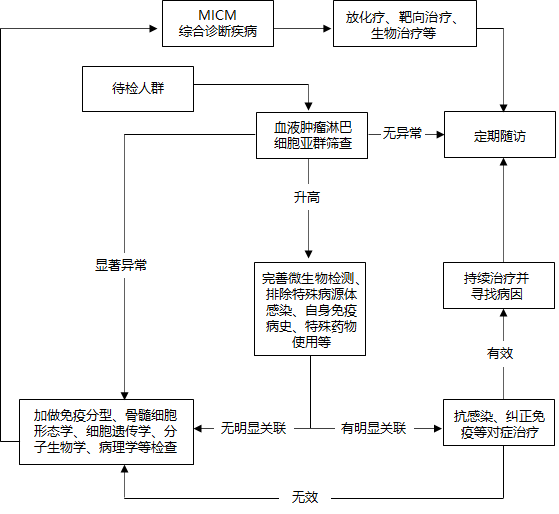
注:MICM表示形体学、免疫学、细胞遗传学及分子生物学分型
2.肿瘤复发、转移风险预警及预后评估
CD3+、CD4+、CD8+T细胞的数量和比例与患者的完全缓解(CR)率、无复发生存期(RFS)和总生存期(OS)呈正相关,而Treg的数量和比例与CR率、RFS和OS呈负相关 [5-9] 。在AML患者中,NK细胞数量和比例与CR率、RFS、OS呈正相关 [10] 。
3.合并感染风险预警
感染是血液肿瘤患者的常见并发症,当CD4+T淋巴细胞绝对计数<500个/μL时,血液肿瘤患者机会性感染风险会大幅升高[11]。初诊时Treg细胞比例升高的血液肿瘤患者,其住院期间感染率明显增加[12]。
4.造血干细胞移植后免疫重建监测及GVHD预防
造血干细胞移植(HSCT)后造血能力持久恢复与免疫系统功能调节密切相关,主要表现为免疫细胞数量的增加和细胞功能状态的恢复。NK细胞一般移植后2~3周可恢复,CD3+CD8+T淋巴细胞一般移植后1~3月恢复,CD3+CD4+T淋巴细胞恢复通常需要1年以上。CD3-CD19+B淋巴细胞移植后恢复时间不定,短至3个月,长至1年半以上。Treg细胞在移植早期通常比例非常低,移植晚期逐渐增多。
具有负调控炎症反应功能的Treg细胞随GVHD等级的增加呈下降趋势,有望成为预测急性GVHD(发生于移植后100d内)和慢性GVHD(发生于移植100d后)的特异性指标[13-14]。因此异基因造血干细胞移植(allo-HSCT)患者在早期植入阶段(输注后2~4周)、移植后早期阶段(输注后1~3月)、移植后晚期阶段(输注后3月以后)都建议行淋巴细胞亚群检测。
5.CAR-T治疗患者的规范化管理和评估
定期监测CAR-T治疗患者体内的CAR-T细胞水平、肿瘤负荷、免疫功能(主要包括淋巴细胞亚群的比例和数量)和相关不良反应(细胞因子释放综合征、神经毒性等),是治疗后病情评估的重要手段[15-16]。患者回输CAR-T细胞后,可通过FCM监测外周血中CAR-T细胞的比例和数量,有条件的实验室还可开展荧光定量聚合酶链反应法(qRT-PCR)监测CAR-T细胞增殖水平。
淋巴亚群检测也被推荐与CAR-T细胞监测同时进行[16]。有研究通过检测患者CAR‑T细胞回输后第15天的外周血淋巴细胞水平,发现低水平的淋巴细胞数(<0.67×109/L)是患者的不良预后因素,显著影响病情缓解[17]。有研究者提出,具有中央记忆T细胞和干细胞样记忆T细胞表型的CAR-T细胞,在体内有更强的增殖能力及更持久的抗肿瘤效应[18-19]。对于CAR-T细胞治疗的患者,有条件的情况下,可以进行CAR-T细胞的精细亚群分析和长期随访。
6.血液肿瘤患者药物治疗指导
对于靶向治疗B-NHL的CD20单抗,B细胞是否完全清除可以用于评估CD20单抗的治疗反应和疗效[20-22]。对于免疫功能严重受损的患者(经过放化疗治疗或合并HIV感染等),患者在治疗过程中严重感染的频率显著增加,建议根据患者的CD4+T细胞数量制定治疗策略;对于移植及个体化免疫治疗患者,则可以参考CD4+/CD8+细胞比值;对于治疗期间合并感染的患者,更需要关注NK细胞或者CD8+T细胞。
7.动态监测与随访时机的选择
健康人群的参考区间可能不能有效评估血液肿瘤患者的免疫功能,建议建立患者个体化的淋巴细胞亚群检测结果的基线,并规律、动态的监测其变化趋势。血液肿瘤患者常伴有免疫功能失衡,初诊时检测患者的淋巴细胞亚群,有助于判断免疫功能的初始状态。放化疗、免疫治疗及靶向治疗期间患者可呈周期性改变,检测淋巴细胞亚群变化可用于评估患者治疗期间免疫功能恢复情况及肿瘤复发和转移风险。建议在治疗结束后半年内每3个月跟踪检测,半年后每6个月进行随访。造血干细胞移植后患者在移植后第14天、第21天、1个月、2个月、3个月、6个月、1年、2年随访建议检测淋巴细胞亚群。建议连续监测患者CAR-T细胞回输前1天、回输后第4天、第7天、第14天、第28天外周血淋巴细胞亚群变化情况,及治疗后2个月、3个月、6个月随访,见下图:
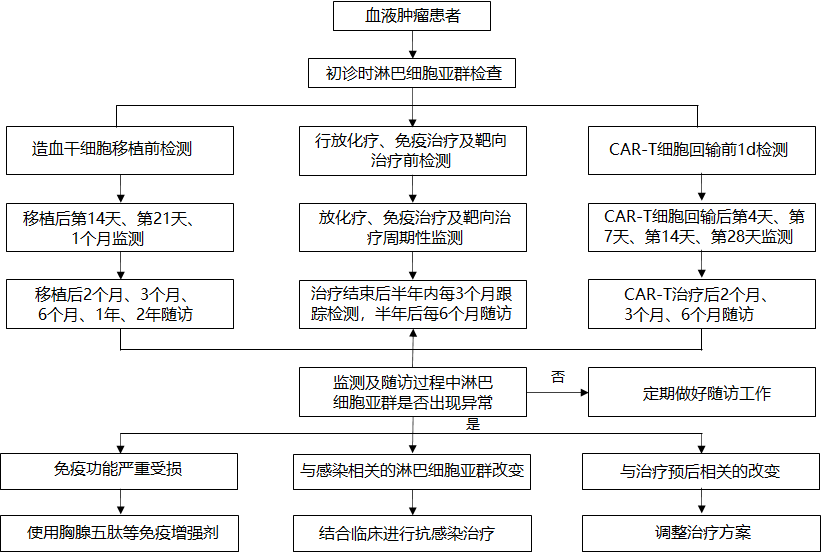
血液肿瘤淋巴细胞亚群检测路径图
淋巴细胞亚群检测在血液肿瘤中具有重要的临床意义和广泛的应用前景,通过TBNK、Treg这些指标,可以评估血液肿瘤患者免疫状况,为疾病诊断、分型,治疗方案的选择、化疗后感染预防,疾病转归等提供实验室依据,以及为血液肿瘤患者的个性化治疗提供参考。
熙宁生物 | 精翰生物流式团队由30余名经验丰富的人员组成,配备BD流式细胞仪、Beckman流式细胞仪、Cytek光谱流式细胞仪等仪器和设备,支持过包括抗体类药物、基因与细胞治疗药物、小分子创新药等各类新药的流式分析检测,其中抗体药物>20个,基因与细胞治疗药物>10 个,小分子创新药>10 个,临床试验>40 个,更是支持国内第一款I 类新药的CAR-T产品- 药明巨诺倍诺达®(瑞基奥仑赛注射液)的样本检测分析工作。平台能够支持包括免疫细胞亚群分型检测,细胞治疗产品的PK/PD 分析,抗体药物的受体占位分析,PD指标蛋白磷酸化、甲基化、乙酰化检测,胞内因子检测等。尤其在血液肿瘤淋巴细胞亚群检测中具有大量的实战经验,欢迎咨询沟通。
参考文献
[1] SEDDIKI N, SANTNER-NANAN B, MARTINSON J, et al. Expression of interleukin (IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cells[J]. J Exp Med, 2006,203(7):1693-1700.
[2] SAISON J, DEMARET J, VENET F, et al. CD4+CD25+CD127- assessment as a surrogate phenotype for FOXP3+ regulatory T cells in HIV-1 infected viremic and aviremic subjects[J]. Cytometry B Clin Cytom, 2013,84(1): 50-54.
[3] YU N, LI X, SONG W, et al. CD4(+)CD25 (+)CD127 (low/-) T cells: a more specific Treg population in human peripheral blood[J]. Inflammation, 2012,35(6): 1773-1780.
[4]《流式细胞术检测外周血淋巴细胞亚群指南》(WS/T 360-2011)
[5] 张司琪, 葛健, 夏瑞祥. 急性白血病患者外周血T细胞亚群、NK细胞和调节性T细胞的检测及临床意义[J]. 安徽医科大学学报, 2016,51(2): 218-221.
[6] 张丹阳, 田登梅, 冯超, 等. 慢性髓系白血病患者外周血T淋巴细胞亚群和NK细胞检测的临床意义[J].标记免疫分析与临床, 2017,24(1): 22-25.
[7] 陆春伟, 佟海侠, 陆美言. 急性白血病患者外周血淋巴细胞亚群和调节性T细胞的检测及临床意义[J].现代肿瘤医学, 2010,18(11): 2230-2233.
[8] 王韧, 刘佩佳, 闫永毅. 外周血T淋巴细胞亚群在白血病病情监测及疗效判定中的检测价值[J]. 国际检验医学杂志, 2019,40(3): 370-372.
[9] 乔文斌. 弥漫大B细胞淋巴瘤患者外周血T淋巴细胞亚群与NK细胞检测的临床意义[D]. 乌鲁木齐:新疆医科大学, 2011.
[10] 张玉玲, 梁艳, 俞钟, 等. 成人急性白血病患者外周血T细胞亚群、NK细胞动态监测[J]. 赣南医学院学报, 2020,40(1): 40-44.
[11] DONG Q, LI G, FOZZA C, et al. Levels and clinical significance of regulatory B cells and T cells in acute myeloid leukemia[J]. Biomed Res Int, 2020,2020: 7023168.
[12] PARK Y, LIM J, KIM S, et al. The prognostic impact of lymphocyte subsets in newly diagnosed acutemyeloid leukemia[J]. Blood Res, 2018,53(3): 198-204.
[13] MAGENAU J M, QIN X, TAWARA I, et al. Frequency of CD4(+)CD25(hi)FOXP3(+) regulatory T cells has diagnostic and prognostic value as a biomarker for acute graft-versus-host-disease[J]. Biol Blood Marrow Transplant, 2010,16(7): 907-914.
[14] WANG W, HONG T, WANG X, et al. Newly found peacekeeper: potential of CD8+ Tregs for graft-versus-host disease[J]. Front Immunol, 2021,12: 764786
[15] DEMARET J, VARLET P, TRAUET J, et al. Monitoring CAR T-cells using flow cytometry[J]. Cytometry B Clin Cytom, 2021,100(2): 218-224.
[16] 中国中西医结合学会检验医学专业委员会. 流式细胞术在嵌合抗原受体‑T细胞免疫治疗相关检验中的应用专家共识[J]. 中华检验医学杂志, 2022,45(8): 790-801.
[17] BANSAL R, NOVO M, AL S A, et al. Peak absolute lymphocyte count after CAR-T infusion predicts clinical response in aggressive lymphoma[J]. Am J Hematol, 2022,97(7): E241-E244
[18] CASTELLA M, CABALLERO-BANOS M, ORTIZ-MALDONADO V, et al. Point-of-care CAR T-Cell production (ARI-0001) using a closed semi-automatic bioreactor: experience from an academic phase I clinical trial[J]. Front Immunol, 2020,11: 482
[19] BLAESCHKE F, STENGER D, KAEUFERLE T, et al. Induction of a central memory and stem cell memory phenotype in functionally active CD4(+) and CD8(+) CAR T cells produced in an automated good manufacturing practice system for the treatment of CD19(+) acute lymphoblastic leukemia[J]. Cancer Immunol Immunother, 2018,67(7): 1053-1066.
[20] DASS S, RAWSTRON A C, VITAL E M, et al. Highly sensitive B cell analysis predicts response to rituximab therapy in arthritis[J]. Arthritis Rheum, 2008,58(10): 2993-2999
[21] GRIGORIADOU S, CHOWDHURY F, PONTARINI E, et al. B cell depletion with rituximab in the treatment of primary Sjogren's syndrome: what have we learnt?[J]. Clin Exp Rheumatol, 2019, 118(3): 217-224.
[22] MEMON A B, JAVED A, CAON C, et al. Long-term safety of rituximab induced peripheral B-cell depletion in autoimmune neurological diseases[J]. PLoS One, 2018,13(1): e190425.